题目内容
17.炙热的炭与浓硫酸可发生反应.(1)写出该反应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(2)现欲设计一个实验以验证此反应所生成的各种产物.实验中可供使用的试剂有:
浓硫酸、稀硫酸、澄清石灰水、NaOH溶液、品红溶液、酸性高锰酸钾溶液、无水硫酸铜固体和碱石灰.有一个同学按气体的流动方向设计了一个实验过程,其所使用的试剂次序可表示为:气体产物→试剂I→试剂Ⅱ→试剂Ⅲ→试剂Ⅱ→试剂Ⅳ.
①试剂I、Ⅱ、Ⅲ、Ⅳ分别为无水硫酸铜、品红溶液、酸性高锰酸钾溶液、澄清石灰水.
②说出试剂Ⅱ使用两次的作用分别是检验是否有SO2生成、检验SO2是否除净.
③写出气体产物通过足量的试剂Ⅳ时的离子方程式:CO2+Ca2++2OH-=CaCO3↓+H2O.
分析 (1)木炭和浓硫酸加热反应生成二氧化硫、二氧化碳和水;
(2)验证碳和浓硫酸反应的产物需要先验证生成的水,依据无水硫酸铜变蓝色说明生成水,再验证二氧化硫,能使品红试液褪色,除去二氧化硫后再用品红试液检验是否除尽,最后用澄清石灰验证二氧化碳.
解答 解:(1)木炭和浓硫酸加热反应生成二氧化硫、二氧化碳和水,反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(2)验证碳和浓硫酸反应的产物需要先验证生成的水,依据无水硫酸铜变蓝色说明生成水,再验证二氧化硫,能使品红试液褪色,除去二氧化硫后再用品红试液检验是否除尽,最后用澄清石灰验证二氧化碳;所以第一次使用二氧化硫时的作用是检验是否有SO2生成,第二次使用二氧化硫的作用是检验SO2是否除净,试剂Ⅳ为二氧化碳和澄清石灰水发生反应生成碳酸钙沉淀和水,
①试剂I、Ⅱ、Ⅲ、Ⅳ分别为:无水硫酸铜、品红溶液、酸性高锰酸钾、澄清石灰水,
故答案为:无水硫酸铜、品红溶液、酸性高锰酸钾溶液、澄清石灰水;
②说出试剂Ⅱ为品红溶液,使用两次的作用分别是第一次使用时的作用是检验是否有SO2生成,第二次使用的作用是检验SO2是否除净,
故答案为:检验是否有SO2生成;检验SO2是否除净;
③气体产物通过足量的试剂Ⅳ时发生反应生成碳酸钙和水,反应的离子方程式为:CO2+Ca2++2OH-=CaCO3↓+H2O,
故答案为:CO2+Ca2++2OH-=CaCO3↓+H2O.
点评 本题考查了浓硫酸性质的应用,产物验证方法和现象判断,注意二氧化碳、二氧化硫都可以使澄清石灰水变浑浊,题目难度中等.

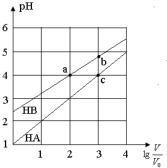 常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )| A. | 相同条件下NaA溶液的pH大于NaB溶液的pH | |
| B. | 溶液中水的电离程度:a=c>b | |
| C. | 该温度下HB的电离平衡常数约等于1.11×10-5 | |
| D. | 当lg$\frac{V}{{V}_{0}}$=3时,若两溶液同时升高温度,则$\frac{c(B-)}{c(A-)}$减小 |
| A. | 提高燃料的燃烧效率的意义在于节约能源、节省资源、减少污染 | |
| B. | CO、NO、NO2、SO2都是大气污染气体,在空气中都能稳定存在 | |
| C. | 按照绿色化学的原则,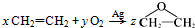 (式中的系数x,y,z均为整数),则(x+y+z)的最小数值为5 (式中的系数x,y,z均为整数),则(x+y+z)的最小数值为5 | |
| D. | 使用“无磷洗涤剂”,防止水体富营养化 |
| A. | 用铁作电极电解饱和食盐水:Fe+2H2O$\frac{\underline{\;电解\;}}{\;}$Fe(OH)2+H2↑ | |
| B. | 偏铝酸钠溶液能使酚酞试液变红:AlO2-+2H2O?Al(OH)3+OH- | |
| C. | 苯酚钠溶液中通入 | |
| D. | AgOH沉淀溶于氨水:AgOH+2NH3•H2O═[Ag(NH3)2]++OH-+2H2O |
| A. | NH3和O2反应 | B. | NH3和HNO3反应 | C. | NO和O2反应 | D. | NH3和水反应 |
| A. | 纸层析以滤纸作为惰性支持物 | |
| B. | 应沿试管壁小心地将展开剂慢慢倒入试管底部 | |
| C. | 纸层析的实质是试样中的各组分在两相之间产生不同分配 | |
| D. | 点样后的滤纸需晾干后,才能将其浸入展开剂中 |

 .
. .
.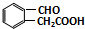 或
或 (任写一种).
(任写一种).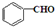 与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为
与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为 .
. .
. ①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是:2Zn+O2═2ZnO.则该电池的负极材料是锌;当导线中有1mol电子通过时,理论上消耗的O2在标准状况下的体积是5.6L.
①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是:2Zn+O2═2ZnO.则该电池的负极材料是锌;当导线中有1mol电子通过时,理论上消耗的O2在标准状况下的体积是5.6L.