题目内容
15.在5L的密闭容器中充入1mol A和2mol B,在一定条件下发生反应4A(g)+5B(g)?4C(g)+6D(g),半分钟后,C的物质的量增加了0.30mol.(1)D的平均反应速率为0.18mol•L-1•min-1 .
(2)A的转化率为30%
(3)不能判断该反应已达平衡状态的是AF.
A单位时间内生成n molA的同时生成2n molD的状态
B生成物浓度不再变化的状态.
C混合气体的平均相对分子质量不再改变的状态.
D混合气体的压强不再改变的状态
E容器中各组分的体积分数不随时间变化的状态
F容器中A、B、C、D的物质的量的比一定是4:5:4:6的状态.
分析 (1)根据v=$\frac{△c}{△t}$进行计算求解;
(2)A的转化率为$\frac{A的变化量}{A的起始量}×100%$;
(3)A单位时间内生成n molA的同时生成2n molD的状态,变化量之比不等物质的量之比;
B生成物浓度不再变化的状态,说明B的物质的量不变;
C混合气体的平均相对分子质量不再改变的状态,说明气体的物质的量不变;
D混合气体的压强不再改变的状态,说明气体的物质的量不变;
E容器中各组分的体积分数不随时间变化的状态,说明各组分的物质的量不变;
F容器中A、B、C、D的物质的量的比一定是4:5:4:6的状态,并不是不变的状态,所以不一定是平衡状态.
解答 解:(1)v(D)=$\frac{△c}{△t}$=$\frac{\frac{\frac{0.3}{4}×6}{5}}{0.5}$=0.18mol•L-1•min-1 ,故答案为:0.18mol•L-1•min-1 ;
(2)A的转化率为$\frac{A的变化量}{A的起始量}×100%$=$\frac{0.3}{1}$=30%,故答案为:30%;
(3)A单位时间内生成n molA的同时生成2n molD的状态,变化量之比不等物质的量之比,所以未平衡,故错误;
B生成物浓度不再变化的状态,说明B的物质的量不变,说明达平衡状态,故正确;
C混合气体的平均相对分子质量不再改变的状态,说明气体的物质的量不变,说明达平衡状态,故正确;
D混合气体的压强不再改变的状态,说明气体的物质的量不变,说明达平衡状态,故正确;
E容器中各组分的体积分数不随时间变化的状态,说明各组分的物质的量不变,说明达平衡状态,故正确;
F容器中A、B、C、D的物质的量的比一定是4:5:4:6的状态,并不是不变的状态,所以不一定是平衡状态,故错误;故选AF.
点评 本题考查化学平衡的计算和化学平衡状态判断,题目难度不大,注意对基础知识的理解、积累.

 有一种蓝色晶体【可表示为MxFey(CN)6】,经射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上,其晶体中阴离子的最小结构单元如图所示,下列说法正确的是( )
有一种蓝色晶体【可表示为MxFey(CN)6】,经射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上,其晶体中阴离子的最小结构单元如图所示,下列说法正确的是( )| A. | 该晶体的化学式为M2Fe2(CN)6 | |
| B. | 该晶体属于离子晶体,M呈+1价 | |
| C. | 该晶体属于离子晶体,M呈+2价 | |
| D. | 晶体中与每个Fe3+距离最近且等距离的CN-为3个 |
| A. | c(NH4+)相等的NH4Cl溶液中的c(Cl-)大于(NH4)2Fe(SO4)2溶液中c(SO42-) | |
| B. | 常温下,pH=1的醋酸与pH=13的NaOH 溶液混合后的溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1mol•L-1的Na2CO3和NaHCO3混合溶液中 2c(Na+)═3c(CO32-)+3c(HCO3-) | |
| D. | 稀释氯化铵溶液过程中,NH4+的水解程度和水的电离程度都增大 |
| A. | 增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增大 | |
| B. | 向某恒容密闭容器中通入1mol SO2和0.5 molO2,达到平衡时放出热量为98.5 kJ | |
| C. | 升高温度能使逆反应速率加快,正反应速率减慢 | |
| D. | 向某恒容密闭容器中通入一定量的SO2和O2达到平衡后,再通入少量气体He,平衡不移动 |
| A. | 金属镁燃烧后会发出耀眼的白光,因此常用来制造信号弹和焰火 | |
| B. | 金属钠在高温下能将TaCl4中的钛置换出来 | |
| C. | 金属镁着火,可用二氧化碳灭火 | |
| D. | 电解熔融NaCl可以得到金属钠 |

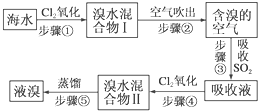
 .
. .
.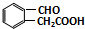 或
或 (任写一种).
(任写一种).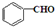 与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为
与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为 .
.
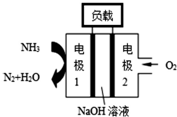 ①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是:2Zn+O2═2ZnO.则该电池的负极材料是锌;当导线中有1mol电子通过时,理论上消耗的O2在标准状况下的体积是5.6L.
①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是:2Zn+O2═2ZnO.则该电池的负极材料是锌;当导线中有1mol电子通过时,理论上消耗的O2在标准状况下的体积是5.6L.