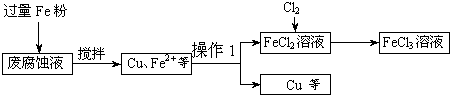
题目内容
5.下列物质的熔点,前者大于后者的是( )| A. | 晶体硅、碳化硅 | B. | 甲苯、苯酚 | C. | 氧化镁、氧化钠 | D. | 钾钠合金、钠 |
分析 A、原子晶体共价键的键长越短,熔点越高;
B、分子晶体的熔点的高低比较相对分子量的大小;
C、离子晶体晶格能越大熔点越高;
D、合金的熔点低于各成份的熔点.
解答 解:A、原子晶体共价键的键长越短,Si-Si>Si-C,所以熔点前者小于后者,故A错误;
B、甲苯和苯酚形成的晶体都是分子晶体,由于苯酚的相对分子质量大于甲苯的,因此甲苯的熔点小于苯酚的熔点,故B错误;
C、氧化镁和氧化钠形成的晶体都是离子晶体,但钠离子半径大于镁离子半径,所以氧化钠中离子键弱于氧化镁中离子键,因此氧化镁的熔点高于氧化钠的熔点,故C正确;
D、合金的熔点低于各成份的熔点,所以钾钠合金的熔点小于钠熔点,故D错误;
故选B.
点评 本题考查较为综合,涉及合金、不同类型的晶体熔点高低等知识,为高频考点,侧重于学生的分析能力的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
16.下列有关实验操作或仪器的使用都正确的是 ( )
| A. |  分液时取出下层液体 | B. |  存放浓硝酸 | ||
| C. |  收集NO气体 | D. |  检查气密性 |
13.下列物质名称书写正确的是( )
| A. | 石炭酸 | B. | 甘胺酸 | C. | 异二戊烯 | D. | 硬酯酸钠 |
20.对醋酸的电离平衡不产生影响的微粒是( )
| A. |  | B. | HBr | C. |  | D. |  |
10.下列离子方程式正确的是( )
| A. | 石灰乳与碳酸钠溶液混合:Ca2++CO32-→CaCO3↓ | |
| B. | 向Ba(OH)2溶液中逐滴加入NH4HSO4 溶液,刚好沉淀完全:Ba2++2OH-+2H++SO42-→BaSO4↓+2H2O | |
| C. | 向亚硫酸钡固体中加入稀硝酸:3BaSO3+2H++2NO3-→3BaSO4↓+2NO↑+H2O | |
| D. | 碳酸氢钠溶液中加入过量的氢氧化钙溶液:2HCO3-+Ca2++2OH-→CaCO3↓+2H2O+CO32- |
17.下列有关化学键与晶体结构说法正确的是( )
| A. | 两种元素组成的分子中一定只有极性键 | |
| B. | 含有阴离子的化合物一定有阳离子 | |
| C. | 非金属元素组成的化合物一定是共价化合物 | |
| D. | 离子化合物的熔点一定比共价化合物的高 |
15.下列说法正确的是( )
| A. | CaCl2晶体中存在共价键 | |
| B. | H2SO4溶于水能电离出H+和SO42-,所以硫酸是离子化合物 | |
| C. | SiO2属于原子晶体,熔化破坏共价键和分子间作用力 | |
| D. | I2是分子晶体,加热升华过程中只需克服分子间作用力 |
 实验室欲配置500mL 0.40mol/L NaNO3溶液.
实验室欲配置500mL 0.40mol/L NaNO3溶液.