题目内容
15.下列说法正确的是( )| A. | CaCl2晶体中存在共价键 | |
| B. | H2SO4溶于水能电离出H+和SO42-,所以硫酸是离子化合物 | |
| C. | SiO2属于原子晶体,熔化破坏共价键和分子间作用力 | |
| D. | I2是分子晶体,加热升华过程中只需克服分子间作用力 |
分析 A.只存在钙离子与氯离子之间的作用力;
B.硫酸只含共价键;
C.SiO2属于原子晶体,不存在分子间作用力;
D.I2是分子晶体,加热升华过程中,状态发生变化,分子不变.
解答 解:A.CaCl2晶体中存在离子键,故A错误;
B.H2SO4溶于水能电离出H+和SO42-,而硫酸是共价化合物,二者无因果关系,故B错误;
C.SiO2属于原子晶体,熔化只破坏共价键,故C错误;
D.I2是分子晶体,加热升华过程中,状态发生变化,分子不变,只需克服分子间作用力,故D正确;
故选D.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注复常见物质中的化学键,题目难度不大.

练习册系列答案
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
5.下列物质的熔点,前者大于后者的是( )
| A. | 晶体硅、碳化硅 | B. | 甲苯、苯酚 | C. | 氧化镁、氧化钠 | D. | 钾钠合金、钠 |
6.下列有机化学反应方程式及反应类型均正确的是( )
| 选项 | 化学反应方程式 | 反应类型 |
| A | CH3COOH+CH3CH2OH $?_{△}^{浓硫酸}$CH3COOCH2CH3 | 酯化反应 |
| B | CH4+Cl2 $\stackrel{光照}{→}$CH3Cl+HCl | 置换反应 |
| C | CH2=CH2+Br2→CH3CHBr2 | 加成反应 |
| D | 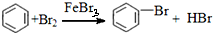 | 取代反应 |
| A. | A | B. | B | C. | C | D. | D |
3.分析表提供的数据,下列说法正确的是( )
| 化学式 | 电离常数 |
| HClO | Ki=3×10-8 |
| H2CO3 | Ki1=4.3×10-7 |
| Ki2=5.6×10-11 |
| A. | 84消毒液(有效成分为NaClO)能杀菌的原因:2ClO-+H2O+CO2→2HClO+CO32- | |
| B. | 25°C时,0.1 mol/L NaClO的pH大于0.1 mol/LNaHCO3的pH | |
| C. | 25°C时,0.1 mol/L NaClO的pH大于0.1 mol/L Na2CO3的pH | |
| D. | 0.1 mol/L NaClO和0.1 mol/L NaHCO3溶液中:c(ClO-)>c(HCO3-) |
10.下列仪器对应名称正确的是( )
| A. |  容量瓶 | B. |  蒸馏烧瓶 | C. |  蒸发皿 | D. |  滴定管 |
20.我国科学及屠呦呦因发现青蒿素(化学式是C15H22O5)而获得2015年诺贝尔奖.青蒿素属于( )
| A. | 有机物 | B. | 氧化物 | C. | 碱 | D. | 盐 |
7.下列说法正确的是( )
| A. | 化学键的形成一定伴随着电子的转移和能量变化 | |
| B. | NaCl和SiC晶体熔化时,克服粒子间作用力的类型相同 | |
| C. | 24Mg32S晶体中电子总数与中子总数之比为1:1 | |
| D. | 某晶体固态不导电水溶液能导电,说明该晶体是离子晶体 |



