题目内容
18.在一定条件下,密闭容器内发生可逆反应mA+nB?zC达到平衡.(1)若A、B、C均为气体,则平衡常数表达式为$\frac{{c}^{z}(C)}{{c}^{m}(A){c}^{n}(B)}$;
(2)若A、B、C均为气体,在减小压强时平衡正向移动,则m+n<z(填“>”、“<”或“=”,下同);
(3)若该反应在任何温度下都能自发进行,则△H<0,△S>0;
(4)若升高温度时平衡逆向移动,则该反应的△H<0;
(5)若A、B、C均为气体,在恒温恒容条件下,继续通入一定量的C气体,达到平衡后测得各气体的体积百分数没有变化,则m+n=z.
分析 (1)根据平衡常数表达式书写,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,固体纯液体不写入表达式;
(2)减小压强时平衡向气体体积增大的方向移动;
(3)根据△G=△H-T•△S<0进行判断;
(4)升温平衡向吸热反应方向进行;
(5)若A、B、C均为气体,在恒温恒容条件下,继续通入一定量的C气体,相当于增大体系压强,达到平衡后测得各气体的体积百分数没有变化说明平衡不变.
解答 解:(1)mA+nB?zC达到平衡,A、B、C均为气体,平衡常数等于生成物的浓度幂之积除以反应物浓度幂之积得到,反应的平衡常数K=$\frac{{c}^{z}(C)}{{c}^{m}(A){c}^{n}(B)}$,
故答案为:$\frac{{c}^{z}(C)}{{c}^{m}(A){c}^{n}(B)}$;
(2)减小压强时平衡向气体体积增大的方向移动,平衡正向移动,所以m+n<z,
故答案为:<;
(3)△H<0,若能够满足△G=△H-T•△S<0,熵值增大即△S>0,在任何温度下都能自发进行,
故答案为:>;
(4)依据化学平衡移动原理可知升温平衡向吸热反应方向进行,若升高温度时平衡逆向移动,逆反应为吸热反应,则该反应正反应的△H<0,
故答案为:<;
(5)若A、B、C均为气体,在恒温恒容条件下,继续通入一定量的C气体,相当于增大体系压强,达到平衡后测得各气体的体积百分数没有变化,证明增大压强平衡不变,说明反应前后气体体积不变,则m+n=z,
故答案为:=.
点评 本题考查平衡常数表达式、化学平衡的移动、焓变和熵变含义、化学平衡影响因素的分析判断,题目难度不大,注意反应能否自发进行取决于焓变和熵变的综合判据,当△G=△H-T•△S<0,能自发进行.

练习册系列答案
相关题目
16.“基因剪刀”(酶)的合成和克隆,为化学治疗提供了一种全新的观念和途径.实验室在适宜的条件下,用含有过氧化氢酶的猪肝研磨液催化过氧化氢分解,比用FeCl3溶液催化过氧化氢分解的速率快得多,这说明与无机催化剂相比,酶具有的特性是( )
| A. | 专一性 | B. | 多样性 | C. | 高效性 | D. | 适应性 |
17. 在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2O(g)?CH3OH(g)达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化曲线如图所示.则下列结论正确的是( )
在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2O(g)?CH3OH(g)达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化曲线如图所示.则下列结论正确的是( )
 在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2O(g)?CH3OH(g)达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化曲线如图所示.则下列结论正确的是( )
在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2O(g)?CH3OH(g)达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化曲线如图所示.则下列结论正确的是( )| A. | 反应CO(g)+2H2O(g)?CH3OH(g)的△H<0 | |
| B. | 图示a点n(CO):n(H2)=0.5,CO转化率最高 | |
| C. | 若在状态Ⅰ和Ⅱ时,再向体系中充入He,重新达到平衡,c(CH3OH,状态Ⅱ)=c(CH3OH,状态Ⅰ) | |
| D. | 正反应速率v正:v正(状态Ⅱ)<v正(状态Ⅲ) |
13.下列说法不正确的是( )
| A. | 在酸性条件下,CH3CO18 OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| B. | 乙醛和丙烯醛不是同系物,它们与H2充分反应后的产物是同系物 | |
| C. | 用溴水可以鉴别苯酚溶液、2,4-己二烯、甲苯和CCl4 | |
| D. | 乳酸薄荷醇酯(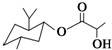 )能发生水解反应、氧化反应、消去反应、取代反应 )能发生水解反应、氧化反应、消去反应、取代反应 |
3.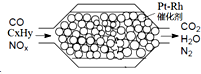 汽车尾气含氮氧化物(NOX)、碳氢化合物(CXHY)、碳等,直接排放容易造成“雾霾”.因此,不少汽车都安装尾气净化装置(净化处理过程如图).下列有关叙述,错误的是( )
汽车尾气含氮氧化物(NOX)、碳氢化合物(CXHY)、碳等,直接排放容易造成“雾霾”.因此,不少汽车都安装尾气净化装置(净化处理过程如图).下列有关叙述,错误的是( )
 汽车尾气含氮氧化物(NOX)、碳氢化合物(CXHY)、碳等,直接排放容易造成“雾霾”.因此,不少汽车都安装尾气净化装置(净化处理过程如图).下列有关叙述,错误的是( )
汽车尾气含氮氧化物(NOX)、碳氢化合物(CXHY)、碳等,直接排放容易造成“雾霾”.因此,不少汽车都安装尾气净化装置(净化处理过程如图).下列有关叙述,错误的是( )| A. | 尾气造成“雾霾”与汽油未充分燃烧有关 | |
| B. | 尾气处理过程,氮氧化物(NOX)被还原 | |
| C. | Pt-Rh催化剂可提高尾气净化反应的平衡转化率 | |
| D. | 使用氢氧燃料电池作汽车动力能有效控制雾霾 |
7.下列关于苯的说法正确的是( )
| A. | 密度比水大 | B. | 能发生取代反应 | ||
| C. | 不能发生燃烧反应 | D. | 不能发生加成反应 |
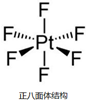 Ⅰ.一定条件下,O2可通过得失电子转化为O2-、O2+ 和O22-.
Ⅰ.一定条件下,O2可通过得失电子转化为O2-、O2+ 和O22-.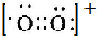 .
.
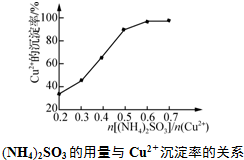 ,工业上$\frac{n[(N{H}_{4})_{2}S{O}_{3}]}{n(C{u}^{2+})}$采用0.6最为适宜,此时(NH4)2SO3略过量,其原因是保证生成的CuCl不被氧气氧化或(NH4)2SO3被空气中的氧气氧化.
,工业上$\frac{n[(N{H}_{4})_{2}S{O}_{3}]}{n(C{u}^{2+})}$采用0.6最为适宜,此时(NH4)2SO3略过量,其原因是保证生成的CuCl不被氧气氧化或(NH4)2SO3被空气中的氧气氧化.