题目内容
8.下列关于电解质溶液的叙述正确的是( )| A. | pH=8.3 的NaHCO3溶液:[Na+]>[HCO3-]>[CO32-]>[H2CO3] | |
| B. | 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液为pH大 |
分析 A.PH=8.3,说明NaHCO3的水解大于电离;
B.酸溶液加水稀释氢离子浓度减小,氢氧根离子浓度增大;
C.醋酸中醋酸的浓度大于氢离子浓度;
D.Na2S的水解程度大于NaHS.
解答 解:A.PH=8.3,说明NaHCO3的水解大于电离,水解生成H2CO3而电离产生CO32-,钠离子不水解,HCO3-)存在两种趋势,但两种趋势都极其微弱,故离子浓度大小顺序为:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故A错误;
B.将pH=4的醋酸溶液稀释后,溶液中氢离子浓度减小,由于c(H+)×c(OH-)不变,所以氢氧根离子浓度增大,故B错误;
C.醋酸中醋酸的浓度大于氢离子浓度,pH与体积均相同的盐酸和醋酸溶液,醋酸的浓度大,所以完全中和时,醋酸消耗的NaOH多,故C错误;
D.Na2S与NaHS水解都显碱性,Na2S的水解程度大于NaHS,所以Na2S溶液pH大于NaHS溶液的pH,故D正确.
故选D.
点评 本题考查较为综合,涉及弱电解质的电离、盐类的水解、以及酸碱混合的定性判断、离子浓度大小比较等,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
相关题目
4.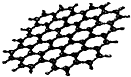 最近,科学家从石墨中分离出来的石墨烯是已知最薄、最坚硬的物质.可以制成纳米材料.其结构如图所示:下列关于石墨烯的说法正确的是( )
最近,科学家从石墨中分离出来的石墨烯是已知最薄、最坚硬的物质.可以制成纳米材料.其结构如图所示:下列关于石墨烯的说法正确的是( )
 最近,科学家从石墨中分离出来的石墨烯是已知最薄、最坚硬的物质.可以制成纳米材料.其结构如图所示:下列关于石墨烯的说法正确的是( )
最近,科学家从石墨中分离出来的石墨烯是已知最薄、最坚硬的物质.可以制成纳米材料.其结构如图所示:下列关于石墨烯的说法正确的是( )| A. | 属于高分子化合物 | B. | 与金刚石互为同分异构体 | ||
| C. | 性质稳定不能与氧气等物质反应 | D. | 能导电 |
16.碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )

| A. | VB2电极发生的电极反应为:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| B. | 外电路中电子由c电极流向VB2电极 | |
| C. | 电解过程中,c电极表面先有红色物质析出,后有气泡产生 | |
| D. | 若B装置内的液体体积为100 mL,则CuSO4溶液的物质的量浓度为0.05 mol/L |
13.用MnO2和浓盐酸反应制取氯气时,当有4mol e-转移时,生成的氯气在标准状况下的体积为( )
| A. | 22.4L | B. | 11.2L | C. | 44.8L | D. | 89.6L |
17.下列有关实验操作的说法正确的是( )
| A. | 用10mL量筒量取8.10mL稀盐酸 | |
| B. | 用pH计测得某溶液的pH为2.3 | |
| C. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 | |
| D. | 可用50.00mL碱式滴定管量取20.00mL KMnO4溶液 |
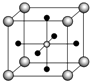 金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”.
金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”.
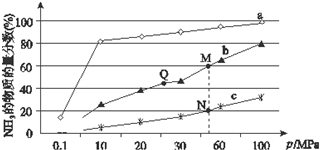 合成氨反应是化学上最重要的反应之一:
合成氨反应是化学上最重要的反应之一: