��Ŀ����
18��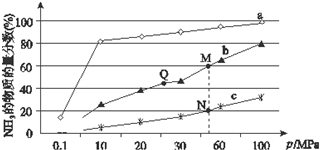 �ϳɰ���Ӧ�ǻ�ѧ������Ҫ�ķ�Ӧ֮һ��
�ϳɰ���Ӧ�ǻ�ѧ������Ҫ�ķ�Ӧ֮һ����1���ϳɰ�ԭ�����е�������������Ȼ������Ҫ�ɷ�ΪCH4���ڸ��¡�������������ˮ������Ӧ�Ƶã���Ӧ��ÿ����2mol CO2����316kJ�������÷�Ӧ���Ȼ�ѧ����ʽ��CH4��g��+2H2O��g��$\frac{\underline{\;����\;}}{\;}$CO2��g��+4H2��g����H=+158kJ•mol-1�÷����Ƶõ�ԭ��������Ҫ������CO2������K2CO3��Һ���գ��÷�Ӧ�����ӷ���ʽ��CO32-+CO2+H2O�T2HCO3-��
��2����֪N2��g��+3H2��g��?2����3��g����H��0����ͼ�ǵ���Ӧ���а�n��N2����n��H2��=1��3Ͷ�Ϻ���200�桢400�桢600���£���Ӧ�ﵽƽ��ʱ���������NH3�����ʵ���������ѹǿ�ı仯���ߣ�
������a��Ӧ���¶���200�森
�ڹ��ڹ�ҵ�ϳɰ��ķ�Ӧ������������ȷ����ABE������ţ�
A����ͼ��M��N��Q��ƽ�ⳣ��K�Ĵ�С��ϵΪK��M��=K��Q����K��N��
B���Ӵ����ܼӿ췴Ӧ���ʵ�H2��ƽ��ת���ʲ���
C����ͬѹǿ�����£�Ͷ����ͬ���ﵽƽ������ʱ���ϵΪc��b��a
D��������a��֪����ѹǿ���ӵ�100MPa���ϣ�NH3�����ʵ��������ɴﵽ100%
E����ʱ�����NH3�������H2��ƽ��ת����
��N��ʱc��NH3��=0.2mol•L-1��N��Ļ�ѧƽ�ⳣ��K=$\frac{25}{27}$����ȷ��С�������λ����
��3���ϳɰ���ҵ�к�����ˮ�Ĵ�������֮һ�ǵ绯ѧ���������������ļ��Է�ˮͨ����ϵͳ���������ϰ��������ɵ������ѳ��������ĵ缫��ӦʽΪ2NH3-6e-+6OH-�TN2+6H2O��
��4��NH3���Դ���NO2 ����Ⱦ������ʽ���£�NO2+NH3$?_{����}^{����}$N2+H2O��δ��ƽ����ת��0.6mol����ʱ�����ĵ�NO2�ڱ�״���µ������3.36L��
���� ��1������2mol������̼����316kJ������������1mol������̼����158kJ���������ݷ�Ӧ������P��Ӧ��������Ӧ����д�Ȼ�ѧ����ʽ��
̼��غͶ�����̼��ˮ��Ӧ����̼�����ƣ�
��2��������Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�������ƶ��������ĺ�����С��
��A��Kֻ���¶�Ӱ�죬�¶Ȳ���ƽ�ⳣ�����䣬����ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���ƽ�ⳣ����С��
B������ֻ�ı䷴Ӧ���ʲ�Ӱ��ƽ���ƶ���
C����ͬѹǿ�����£�Ͷ����ͬ���¶�Խ�߷�Ӧ����Խ��Ӧ�ﵽƽ��ʱ��Խ�̣�
D�����淴Ӧ�д��ڻ�ѧƽ�⣻
E����ʱ�����NH3ƽ�������ƶ���
�۸��ݷ�ӦN2��g��+3H2��g��?2NH3��g����������ʽ�����ƽ��ʱ�����ʵ�Ũ�ȣ�������ƽ�ⳣ����
��3�����ɵ�����Ⱦ������Ϊ���������ݵ��ԭ��д�������缫��Ӧʽ��
��4����Ӧ6NO2+8NH3$?_{����}^{����}$7N2+12H2O����ʽ��֪6NO2����24mole-���Դ������
��� �⣺��1������2mol������̼����316kJ������������1mol������̼����158kJ���������ݷ�Ӧ������P��Ӧ��������Ӧ����д�Ȼ�ѧ����ʽΪ��
̼��غͶ�����̼��ˮ��Ӧ����̼�����ƣ����ӷ���ʽΪCO32-+CO2+H2O�T2HCO3-��
�ʴ�Ϊ��CH4��g��+2H2O��g��$\frac{\underline{\;����\;}}{\;}$CO2��g��+4H2��g����H=+158kJ•mol-1 ��CO32-+CO2+H2O�T2HCO3-��
��2���ٺϳɰ��ķ�ӦΪ���ȷ�Ӧ����Ӧ�¶�Խ�ߣ�Խ�����ڷ�Ӧ������У�����a�İ��������ʵ���������ߣ��䷴Ӧ�¶ȶ�Ӧ�����ͣ�����a���߶�Ӧ�¶�Ϊ200�棻
�ʴ�Ϊ��200�棻
��A��ƽ�ⳣ�����¶��йأ������������أ��¶���ͬʱƽ�ⳣ����ͬ����Ӧ�Ƿ��ȷ�Ӧ���¶�Խ��ƽ�ⳣ��ԽС����M��N��Q��ƽ�ⳣ��K�Ĵ�С��ϵ��K��M��=K��Q����K��N��������ȷ��
B��������ͬ�ȳ̶ȵĸı����淴Ӧ���ʣ���ƽ�ⲻ�ƶ�������ȷ��
C����ͬѹǿ�����£�Ͷ����ͬ���¶�Խ�߷�Ӧ����Խ��Ӧ�ﵽƽ��ʱ��Խ�̣��¶ȣ�a��b��c����ﵽƽ������ʱ���ϵΪc��b��a���ʴ���
D�����淴Ӧ�д��ڻ�ѧƽ�⣬���ﵽƽ��״̬ʱ���淴Ӧ������ȣ���Ӧ�ﲻ����ȫת��Ϊ������ʴ���
E����ʱ�����NH3ƽ�������ƶ�����������H2��ƽ��ת���ʣ�����ȷ��
��ѡABE��
��N��ʱ�������ʵ����ķ���Ϊ20%����������ʽ����N2ת������b��N2����ʼŨ��Ϊa��
���ݷ�ӦN2��g��+3H2��g��?2NH3��g��
��ʼ a 3a 0
ת�� ab 3ab 2ab
ƽ�� a-ab 3a-3ab 2ab
����������$\left\{\begin{array}{l}{\frac{2ab}{a-ab+3a-3ab+2ab}=20%}\\{2ab=0.2}\end{array}\right.$������a=0.3��b=$\frac{1}{3}$������ƽ�ⳣ��K=$\frac{��2ab��^{2}}{��a-ab������3a-3ab��^{3}}$=$\frac{25}{27}$��
�ʴ�Ϊ��$\frac{25}{27}$��
��3�����õ�ⷨ��NH3•H2Oת��Ϊ�Ի�������Ⱦ������Ϊ����������ʧȥ���ӷ���������Ӧ���缫��ӦʽΪ��2NH3-6e-+6OH-=N2+6H2O��
�ʴ�Ϊ��2NH3-6e-+6OH-=N2+6H2O��
��4����Ӧ6NO2+8NH3$?_{����}^{����}$7N2+12H2O����ʽ��֪6NO2����24mole-���������ĵ�NO2�ڱ�״���µ������$\frac{0.6}{24}$��6��22.4L=3.36L��
�ʴ�Ϊ��3.36��
���� ���⿼�黯ѧƽ����㡢���ԭ����������ԭ��Ӧ���㡢��ѧƽ��Ӱ�����ص�֪ʶ�㣬���ؿ���ѧ��ʶͼ������������������ȷ��ѧ��Ӧԭ���ǽⱾ��ؼ���֪��ƽ�ⳣ���ļ��㷽������Ŀ�Ѷ��еȣ�

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�| A�� | pH=8.3 ��NaHCO3��Һ��[Na+]��[HCO3-]��[CO32-]��[H2CO3] | |
| B�� | ��pH=4�Ĵ�����Һϡ�ͺ���Һ���������ӵ�Ũ�Ⱦ����� | |
| C�� | �к�pH���������ͬ������ʹ�����Һ������NaOH�����ʵ�����ͬ | |
| D�� | �����£�ͬŨ�ȵ�Na2S��NaHS��Һ��ȣ�Na2S��ҺΪpH�� |
| ���� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0�� |
| 2 | �� | �� | �� | |||||
| 3 | �� | �� | �� | �� | �� | |||
| 4 | �� |
��2��NH4H����ʽ�ǣ�
 ��
����3����ʾ����ߵĻ�����Ľṹʽ
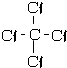 ��
����4��д�� ��ԭ�ӽṹʾ��ͼ
 ��
����5������̬�⻯��ķе���ڣ�����ڡ�����С�ڡ�������̬�⻯��ķе㣮
| A�� | �����ᷴӦ���ų���״���µ�22.4L���壬ת�Ƶĵ�������Ϊ2NA | |
| B�� | ����״���£�11.2LN2��33.6LH2��ϣ���һ�������³�ַ�Ӧ��������NH3�ķ�����Ϊ2NA | |
| C�� | ���³�ѹ�£�6g�����������ۼ���ĿΪ0.7NA | |
| D�� | 1L 0.1mol•L-1̼������Һ�У���������Ŀ����0.1NA |
| A�� | ��FeBr2��Һ��ͨ������������2Fe2++4Br-+3Cl2�T2Fe3++2Br2+6Cl- | |
| B�� | Cl2ͨ��ˮ�У�Cl2+H20�T2H++Cl-+ClO- | |
| C�� | ��ͭ���缫���CuSO4��Һ��2Cu2++2H20�T2Cu+O2+4H+ | |
| D�� | ������Һ�е���Ba��OH��2��ҺʹS042-ǡ����ȫ������2Ba2++3OH-+Al3++2S042-�T2BaS04+Al��OH��3 |

��֪������ԭ��ʱ��FeS2��H2SO4����Ӧ��Fe3+ͨ����Ӧ��ԭ�����з�Ӧ�����£�
FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
�ش��������⣺
��1�����������ܡ�ʱ������Ӧ�Ļ�ѧ����ʽΪFe2O3+3H2SO4=Fe2��SO4��3+3H2O��FeO+H2SO4=FeSO4+H2O��
��2����һ�ι����������ġ���������SiO2���ѧʽ����
��3������FeS2��ԭ����Fe3+�Ƿ�Ӧ��ȫ���Լ�ΪKSCN��Һ��
��4������FeCO3����ϴ�ӣ������Ƿ�ϴ���ķ�����ȡ�������һ��ϴ��Һ���Թ��У��μ�ϡ���ᣬ�����������ٵμ�BaCl2��Һ�����ް�ɫ�������ɣ��������ϴ�Ӹɾ�����֮����˵��ûϴ�Ӹɾ�����������ʱ��pH���˹��ߣ������Ʊ���FeCO3�п��ܻ��е�������Fe��OH��3��
��5����д������ԭ��ʱ��Ӧ������ӷ���ʽ��2Fe3++FeS2=3Fe2++2S����
�ڡ���ԭ��ǰ����Һ�в������ӵ�Ũ�ȼ��±�����Һ����仯���Բ��ƣ���
| ���� | ����Ũ�ȣ�mol•L-1�� | |
| ��ԭǰ | ��ԭ�� | |
| Fe2+ | 0.10 | 2.5 |
| SO42- | 3.5 | 3.7 |
��6�������ι������õ��ġ���Һ���д������ڵ�������NH4+��CO32-��SO42-�������ӷ��ţ�
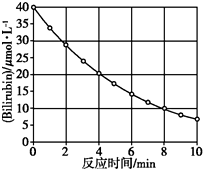 ������Bilirubin��һ�������Ĺ������·����ֽⷴӦ����Ӧ��Ũ���淴Ӧʱ��仯��ͼ��ʾ�����㷴Ӧ4��8 min���ƽ����Ӧ���ʺ��ƲⷴӦ16 minʱ��Ӧ���Ũ�ȣ����Ӧ�ǣ�������
������Bilirubin��һ�������Ĺ������·����ֽⷴӦ����Ӧ��Ũ���淴Ӧʱ��仯��ͼ��ʾ�����㷴Ӧ4��8 min���ƽ����Ӧ���ʺ��ƲⷴӦ16 minʱ��Ӧ���Ũ�ȣ����Ӧ�ǣ�������| A�� | 2.5 ��mol/�� L•min����2.0 ��mol/L | B�� | 2.5 ��mol/�� L•min����2.5 ��mol/L | ||
| C�� | 3.0 ��mol/�� L•min����3.0 ��mol/L | D�� | 5.0 ��mol/�� L•min����3.0 ��mol/L |

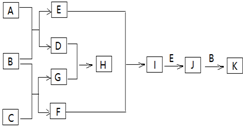 �й����ʵ�ת����ϵ��ͼ��ʾ��������������������ȥ������֪AΪ����ɫ���壬BΪ��������ɫҺ�壬CΪ����Ԫ����ɵĻ����Ħ������Ϊ150g/mol��EΪ�������壬FΪ��̬�⻯��г�������ζ��GΪ�����������KΪ�������ᣮ
�й����ʵ�ת����ϵ��ͼ��ʾ��������������������ȥ������֪AΪ����ɫ���壬BΪ��������ɫҺ�壬CΪ����Ԫ����ɵĻ����Ħ������Ϊ150g/mol��EΪ�������壬FΪ��̬�⻯��г�������ζ��GΪ�����������KΪ�������ᣮ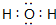 ��
��