题目内容
3. 金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”.
金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”.(1)Ti基态原子的电子排布式为s22s22p63s23p63d24s2.
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物.电负性:C>(填“>”或“<”,下同)B;第一电离能:N>O.
(3)月球岩石--玄武岩的主要成分为钛酸亚铁(FeTiO3).FeTiO3与80%的硫酸反应可生成TiOSO4.SO42-的空间构型为正四面体形,其中硫原子采用sp3杂化,写出SO42-的一种等电子体的化学式:ClO4-.
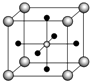
(4)Ti的氧化物和CaO相互作用能形成钛酸盐CaTiO3,CaTiO3的晶体结构如图所示(Ti4+位于立方体的顶点).该晶体中,Ti4+和周围12个O2-相紧邻.
分析 (1)Ti原子核外电子数为22,根据能量最低原理书写核外电子排布式;
(2)同周期自左而右元素电负性增大;N原子中的2p轨道处于半充满状态,更稳定,第一电离能高于同周期相邻元素的;
(3)SO42-中S原子孤电子对数=$\frac{6+2-2×4}{2}$=0,价层电子对数=4+0=0,杂化轨道数目为4,据此确定空间构型与杂化方式;原子数目相同、价电子总数相同的微粒互为等电子体;
(4)CaTiO3的晶体结构中Ti4+位于立方体的顶点,由晶胞结构图可知,体心为Ca2+,面心为O2-,该晶体中每个顶点Ti4+与面心的O2-相邻,每个顶点为8个晶胞共用,每个面为2个晶胞共用.
解答 解:(1)Ti原子核外电子数为22,根据能量最低原理,核外电子排布式为:1s22s22p63s23p63d24s2,
故答案为:1s22s22p63s23p63d24s2;
(2)同周期自左而右元素电负性增大,故电负性C>B,N原子中的2p轨道处于半充满状态,更稳定,第一电离能高于同周期相邻元素的,故第一电离能N>O,
故答案为:>;>;N原子中的2p轨道处于半充满状态,更稳定;
(3)SO42-中S原子孤电子对数=$\frac{6+2-2×4}{2}$=0,价层电子对数=4+0=0,为正四面体结构,杂化轨道数目为4,S原子杂化方式为sp3;原子数目相同、价电子总数相同的微粒互为等电子体,SO42-的一种等电子体的化学式:ClO4-等,
故答案为:正四面体;sp3;ClO4-等;
(4)CaTiO3的晶体结构中Ti4+位于立方体的顶点,由晶胞结构图可知,体心为Ca2+,面心为O2-,该晶体中每个顶点Ti4+与面心的O2-相邻,每个顶点为8个晶胞共用,每个面为2个晶胞共用,晶体中,Ti4+和周围紧相邻O2-数目为$\frac{3×8}{2}$=12,
故答案为:12.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电负性、电离能、空间构型与杂化方式判断、等电子体、晶胞结构与计算,注意能级处于半满、全满时元素的第一电离能高于同周期相邻元素,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案| A. | 11 | B. | 7 | C. | 5 | D. | 3 |
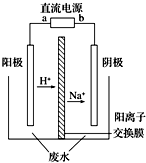 最近有研究人员发现了一种处理高浓度乙醛废水的新方法--隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )
最近有研究人员发现了一种处理高浓度乙醛废水的新方法--隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )| A. | 电解过程中,阴极区消耗Na+ | |
| B. | 阳极反应为CH3CHO-2e-+2H+═CH3COOH+H2O | |
| C. | 电解的总反应方程式为2CH3CHO+H2O$\frac{\underline{\;电解\;}}{\;}$CH3COOH+CH3CH2OH | |
| D. | 若以CH4-空气燃料电池为直流电源,燃料电池的b极应通入空气 |
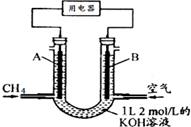 将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.则下列说法正确的是( )
将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.则下列说法正确的是( )| A. | OH-由A端移向B端 | |
| B. | 0<V≤22.4L时,电池总反应的化学方程式为:CH4+2O2+KOH═KHCO3+2H2O | |
| C. | 22.4L<V≤44.8L时,负极电极反应为:CH4-8e-+9CO32-+3H2O=10HCO3- | |
| D. | V=33.6L时,溶液中阴离子浓度大小关系为:c(CO32- )>c(HCO3- )>c(OH-) |
| A. | ①④都要用到锥形瓶 | B. | ②③都要用到温度计 | ||
| C. | ③④都要用到酒精灯 | D. | ①②都要用到指示剂 |
| A. | 核外电子排布完全相同的两种微粒,其化学性质一定相同 | |
| B. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 | |
| C. | 核外电子排布相同的两中性原子一定属于同种元素 | |
| D. | 阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同 |
| A. | pH=8.3 的NaHCO3溶液:[Na+]>[HCO3-]>[CO32-]>[H2CO3] | |
| B. | 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液为pH大 |
 .
.

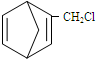 ,含共轭结构的原料可以是
,含共轭结构的原料可以是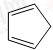 或
或 .(写结构简式)
.(写结构简式) 的合成路线(其他无机试剂任选).
的合成路线(其他无机试剂任选).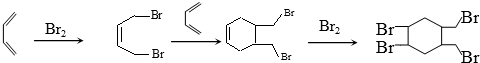 .
.