题目内容
16.在原子序数1-18号元素中,按要求用合适的化学用语填空(1)与水反应最剧烈的金属是Na.
(2)与水反应最剧烈的非金属单质是F2.
(3)原子半径最小的元素是H.
(4)气态氢化物最稳定的化学式是HF.
(5)最高价氧化物对应水化物的酸性最强的化学式是HClO4.
(6)电子数为10的分子(写5个)CH4、NH3、H2O、HF、Ne
(7)气态氢化物水溶液显碱性的元素对应氢化物的电子式为
 .
.
分析 根据元素周期律的递变规律比较元素、单质以及对应化合物的性质,结合原子结构解答电子数为10的化合物,氮元素的气态氢化物的水溶液显碱性,则对应氢化物为氨气,氨气中存在3个氮氢键,氮原子最外层8个电子,据此书写电子式.
解答 解:(1)在原子序数1-18号元素中,与水反应最剧烈的金属是Na,金属性最强,
故答案为:Na;
(2)与水反应最剧烈的非金属单质是F2,F元素的非金属性最强,
故答案为:F2;
(3)原子半径最小的元素是H,原子核外只有1个电子,
故答案为:H;
(4)最稳定气态氢化物对应的元素的非金属性应最强,为HF,
故答案为:HF;
(5)最高价氧化物对应水化物的酸性最强的元素为Cl,非金属性仅次于F、O,但F、O无正价,不存在对应的酸,化学式是HClO4,
故答案为:HClO4;
(6)因H的质子数为1,C的质子数为6,N的质子数为7,O的质子数为8,F的质子数为9,Ne的质子数为10,在中性微粒中,质子数等于电子数,
则CH4、NH3、H2O、HF、Ne的电子数都是10,
故答案为:CH4、NH3、H2O、HF、Ne;
(7)氮元素的气态氢化物的水溶液显碱性,则对应氢化物为氨气,分子中H原子与N原子之间形成1对共用电子对,电子式为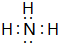 ,
,
故答案为: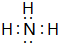 .
.
点评 本题考查原子结构和元素周期律的关系,题目难度不大,注意基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
(1)某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了能量最低原理.
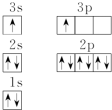
(2)ACl2分子中A的杂化类型为sp杂化.
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确否,并阐述理由C60为分子晶体,熔化时破坏的是范德华力,无需破坏共价键,而金刚石属于原子晶体,熔化时需要破坏共价键.
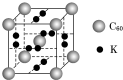
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体.写出基态钾原子的价电子排布式4s1,该物质的K原子和C60分子的个数比为3:1.
(5)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是N>C>Si,NCl3分子的空间构型为三角锥形.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为30.
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |

(2)ACl2分子中A的杂化类型为sp杂化.
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确否,并阐述理由C60为分子晶体,熔化时破坏的是范德华力,无需破坏共价键,而金刚石属于原子晶体,熔化时需要破坏共价键.
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体.写出基态钾原子的价电子排布式4s1,该物质的K原子和C60分子的个数比为3:1.

(5)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是N>C>Si,NCl3分子的空间构型为三角锥形.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为30.
7.不溶于水且比水轻的一组液体是( )
| A. | 甲苯、四氯化碳 | B. | 硝基苯、二氯甲烷 | C. | 己烯、苯 | D. | 酒精、溴 |
4.把3mol铜粉投入含4mol硝酸和1mol硫酸的稀溶液中,则放出的气体(假设气体全为NO)的物质的量为( )
| A. | 1mol | B. | 1.5mol | C. | 2mol | D. | 2.5mol |
11.根据下列合成路线判断反应类型正确的是( )
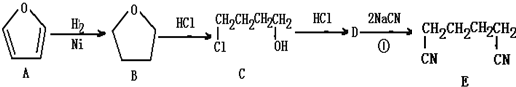
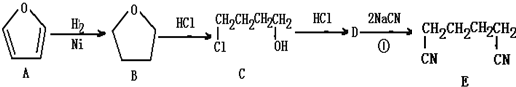
| A. | A→B的反应属于加成反应 | B. | B→C的反应属于酯化反应 | ||
| C. | C→D的反应属于消去反应 | D. | D→E的反应属于加成反应 |
1.下列实验能获得成功的是( )
| A. | 将乙醛滴入银氨溶液中,加热煮沸制银镜 | |
| B. | 苯与溴水反应制取溴苯 | |
| C. | 向少量苯酚稀溶液中逐滴加入饱和溴水,边加边振荡,观察沉淀 | |
| D. | 1mol•L-1CuSO4溶液2mL和0.5mol•L-1NaOH溶液4mL混合后加入40%的乙醛溶液0.5mL,加热煮沸观察沉淀的颜色 |
5.金属镍有广泛的用途.粗镍中含有少量Fe、Cu、Pt等杂质,可用电解法制备高纯度的镍(用 NiSO4作电解质溶液).已知:氧化性Fe2+<Ni2+<Cu 2+,下列叙述正确的是( )
| A. | 阳极发生还原反应,其电极反应式:Ni2++2e-═Ni | |
| B. | 电解过程中,阳极质量的减少与阴极质量的增加相等 | |
| C. | 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ | |
| D. | 电解后,可以从电解槽底部的阳极泥中回收Cu和Pt |
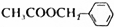 )是其中的一种,它可以从茉莉花香中提取,也可以用甲苯和乙醇为原料进行人工合成,一种合成路线如下:
)是其中的一种,它可以从茉莉花香中提取,也可以用甲苯和乙醇为原料进行人工合成,一种合成路线如下:
 .
. ,名称为苯甲醇.
,名称为苯甲醇.