题目内容
6.纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
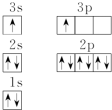
(2)ACl2分子中A的杂化类型为sp杂化.
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确否,并阐述理由C60为分子晶体,熔化时破坏的是范德华力,无需破坏共价键,而金刚石属于原子晶体,熔化时需要破坏共价键.
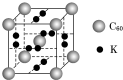
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体.写出基态钾原子的价电子排布式4s1,该物质的K原子和C60分子的个数比为3:1.
(5)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是N>C>Si,NCl3分子的空间构型为三角锥形.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为30.
分析 由表中电离能可知,二者第三电离能剧增,故为+2价,都为短周期元素,故A为铍、B为Mg.
(1)由图1电子轨道排布图可知,3s能级未填满就填充3p能级,而3s能级能量比3p能级低;
(2)BeCl2分子中Be的成2个σ键,没有孤对电子对,杂化轨道数为2;
(3)C60为分子晶体,熔化时破坏的是范德华力,无需破坏共价键,而金刚石属于原子晶体,熔化时需要破坏共价键;
(4)K原子核外电子数为19,根据能量最低原理书写基态钾原子的价电子排布式;
根据均摊法计算晶胞中K原子和C60分子的个数比;
(5)同周期自左而右电负性增大,同主族自上而下电负性减小;
NCl3分子中N原子孤电子对数=$\frac{5-1×3}{2}$=1,价层电子对数=3+1=4;
Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则每个Si原子形成的3个键中有2个单键、1个双键,根据均摊法可知Si60分子中单键、双键总数目为60×3×$\frac{1}{2}$=90.
解答 解:由表中电离能可知,二者第三电离能剧增,故为+2价,都为短周期元素,故A为铍、B为Mg.
(1)由图1电子轨道排布图可知,3s能级未填满就填充3p能级,而3s能级能量比3p能级低,违背了能量最低原理,
故答案为:能量最低原理;
(2)BeCl2分子中Be的成2个σ键,没有孤对电子对,杂化轨道数为2,Be原子采取sp杂化,
故答案为:sp杂化;
(3)C60为分子晶体,熔化时破坏的是范德华力,无需破坏共价键,而金刚石属于原子晶体,熔化时需要破坏共价键,故C60的熔点低于金刚石的,该同学说法不正确,
故答案为:否;C60为分子晶体,熔化时破坏的是范德华力,无需破坏共价键,而金刚石属于原子晶体,熔化时需要破坏共价键;
(4)K原子核外电子数为19,根据能量最低原理,基态钾原子的价电子排布式为:4s1,
晶胞中K原子数目为12×$\frac{1}{2}$=6、C60分子个数为1+8×$\frac{1}{8}$=2,故晶胞中K原子和C60分子的个数比6:2=3:1,
故答案为:4s1;3:1;
(5)同周期自左而右电负性增大,同主族自上而下电负性减小,故电负性:N>C>Si,
NCl3分子中N原子孤电子对数=$\frac{5-1×3}{2}$=1,价层电子对数=3+1=4,空间结构为三角锥形,
Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则每个Si原子形成的3个键中有2个单键、1个双键,根据均摊法可知Si60分子中单键、双键总数目为60×3×$\frac{1}{2}$=90,则Si60分子中π键的数目为90×$\frac{1}{3}$=30,
故答案为:N>C>Si;三角锥形;30.
点评 本题是对物质结构与性质的考查,涉及电离能、杂化方式与空间构型判断、核外电子排布、晶体类型与性质、晶胞结构与计算等,注意理解电离能剧增与能级能量问题,(5)中注意根据8电子结构判断Si原子常见情况,再结合均摊法计算化学键数目.

| 相关信息 | |
| A | 所处的周期数、族序数分别与其原子序数相等 |
| B | 原子核外电子有4种不同的运动状态 |
| C | 元素原子的核外成对电子数是未成对电子数的2倍且有3个能级 |
| D | 元素原子的核外p电子数比s电子数少1 |
| E | E原子的第一至第四电离能如下: I1=738kJ•mol-1 I2=1451kJ•mol-1 I3=7733kJ•mol-1 I4=10540kJ•mol-1 |
| F | 第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满 |
(1)F位于元素周期表第ⅠB族,其简化电子排布式为[Ar]3d104s1.
(2)D元素基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈哑铃形.
(3)某同学根据上述信息,推断E基态原子的核外电子排布图为:
 ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.(4)A与D形成的D2A4分子中D原子的杂化类型为sp3杂化,A与D形成的最简单分子易溶于水的原因氨气分子能与水分子形成氢键.
(5)C的一种单质相对分子质量为720,分子构型为一个32面体,其中有12个五元环,20个六元环(如图1).则1个这种单质分子中所含π键的数目为30.
(6)已知在元素周期表中存在“对角线规则”,即周期表中左上方与右下方元素它们的单质及其化合物性质相似,如Li和Mg,试写出DCl2溶液中加入过量的NaOH溶液反应的化学方程式:BeCl2+4NaOH═Na2BeO2+2NaCl+2H2O.
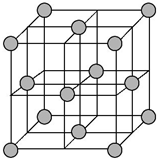
(7)图2是金属Ca和F所形成的某种合金的晶胞结构示意图,已知铜镍合金与上述合金具有相同类型的晶胞结构XYa,它们有很强的储氢能力.已知铜镍合金LaNin晶胞体积为9.0×10-33cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=5(填数值);氢在合金中的密度为0.083g•cm-3.

| A. | 铁片为正极,碳棒为负极 | |
| B. | 碳棒附近的溶液可使酚酞变红 | |
| C. | 铁被腐蚀,碳棒上有氯气放出 | |
| D. | 导线上有电流通过,电流方向是由铁极流向碳极 |
 蛋白质中含有C、H、O、N、S等元素,食物中的铁主要以三价铁与蛋白质和羧酸结合成络合物的形式存在.
蛋白质中含有C、H、O、N、S等元素,食物中的铁主要以三价铁与蛋白质和羧酸结合成络合物的形式存在.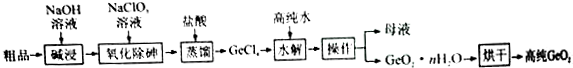
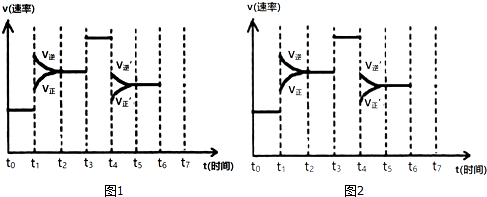
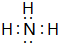 .
.