题目内容
5.金属镍有广泛的用途.粗镍中含有少量Fe、Cu、Pt等杂质,可用电解法制备高纯度的镍(用 NiSO4作电解质溶液).已知:氧化性Fe2+<Ni2+<Cu 2+,下列叙述正确的是( )| A. | 阳极发生还原反应,其电极反应式:Ni2++2e-═Ni | |
| B. | 电解过程中,阳极质量的减少与阴极质量的增加相等 | |
| C. | 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ | |
| D. | 电解后,可以从电解槽底部的阳极泥中回收Cu和Pt |
分析 A、阳极失去电子发生氧化反应;
B、阳极失电子的有Fe、Zn、Ni;阴极析出的是镍;依据电子守恒计算分析;
C、电解过程中,NiSO4作电解质溶液,电解质溶液中一定含有Ni2+;
D、粗镍中含有少量Fe、Zn、Cu、Pt等杂质做阳极,铜和鉑不失电子沉降电解池底部形成阳极泥.
解答 解:A、阳极发生氧化反应,其电极反应式:Ni-2e-=Ni2+,Fe-2e-=Fe2+;Zn-2e-=Zn2+;故A错误;
B、电解过程中阳极失电子的有Fe、Zn、Ni;阴极析出的是镍;依据电子守恒,阳极质量的减少与阴极质量的增加不相等,故B错误;
C、电解后,溶液中存在的金属阳离子有Fe2+、Zn2+、Ni2+;故C错误;
D、粗镍中含有少量Fe、Zn、Cu、Pt等杂质做阳极,铜和鉑不失电子沉降电解池底部形成阳极泥,电解后,电解槽底部的阳极泥中只有Cu和Pt,故D正确;
故选:D.
点评 本题考查了电解原理的应用,主要考查电解精炼镍的原理分析判断,题目难度中等.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
15.如图装置中久置后铁片会被腐蚀,有关此装置的叙述中正确的是( )


| A. | 铁片为正极,碳棒为负极 | |
| B. | 碳棒附近的溶液可使酚酞变红 | |
| C. | 铁被腐蚀,碳棒上有氯气放出 | |
| D. | 导线上有电流通过,电流方向是由铁极流向碳极 |
13.下列关于同系物的叙述中不正确的是( )
| A. | 某有机物同系物组成可用通式CnH2n+2表示 | |
| B. | 同系物互为同分异构体 | |
| C. | 两个同系物之间相对分子质量相差14或14的整数倍 | |
| D. | 同系物具有相似的化学性质 |
20.篮烷的结构如图所示.下列说法正确的是( )
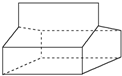

| A. | 篮烷的分子式为C12H12 | |
| B. | 篮烷分子中存在3个六元环 | |
| C. | 篮烷分子中存在3个五元环 | |
| D. | 篮烷的一氯代物共有5种同分异构体 |
10.下列化学反应属于吸热反应的是( )
| A. | NH4Cl与Ba(OH)2•8H2O研磨 | B. | 生石灰溶于水 | ||
| C. | 镁与稀盐酸反应 | D. | 甲烷燃烧 |
17.表是元素周期表的一部分,针对表中的①~⑧种元素,填写下列空白:
(1)⑧号元素的最高价氧化物对应的水化物的化学式为HClO4,③号元素氢化物的化学式为NH3,其电子式为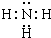
(2)写出⑤的最高价氧化物对应的水化物与⑥的最高价氧化物反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
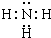
(2)写出⑤的最高价氧化物对应的水化物与⑥的最高价氧化物反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O.
14.下列物质不属于高分子化合物的是( )
| A. | 油脂 | B. | 淀粉 | C. | 蛋白质 | D. | 纤维素 |
15.氢气能在某黄绿色单质气体中燃烧,该黄绿色单质气体所含元素在周期表中的位置是( )
| A. | 第一周期第ⅠA族 | B. | 第二周期第VⅡA族 | C. | 第三周期第VⅡA族 | D. | 第三周期第ⅥA族 |
 .
.