题目内容
1.下列实验能获得成功的是( )| A. | 将乙醛滴入银氨溶液中,加热煮沸制银镜 | |
| B. | 苯与溴水反应制取溴苯 | |
| C. | 向少量苯酚稀溶液中逐滴加入饱和溴水,边加边振荡,观察沉淀 | |
| D. | 1mol•L-1CuSO4溶液2mL和0.5mol•L-1NaOH溶液4mL混合后加入40%的乙醛溶液0.5mL,加热煮沸观察沉淀的颜色 |
分析 A.银镜反应需要水浴加热;
B.苯和液溴在溴化铁作催化剂条件下发生取代反应生成溴苯;
C.苯酚和溴水发生取代反应;
D.碱应过量,反应在碱性条件下进行.
解答 解:A.银镜反应要在水浴加热的条件下,将乙醛滴入银氨溶液中,加热煮沸得到黑色沉淀,故A错误;
B.苯和溴在溴化铁作催化剂条件下反应制备溴苯,不能用溴水,故B错误;
C.苯酚和溴水发生取代反应生成三溴苯酚白色沉淀,故C正确;
D.1mol/L CuSO4溶液2mL和0.5mol/L NaOH溶液4mL混合后恰好反应生成氢氧化铜,碱应过量,故D错误.
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及物质制备、物质检验,明确实验原理、物质性质、实验操作方法是解本题关键,注意D反应必须在碱性条件下进行,为易错点.

练习册系列答案
相关题目
11.A、B、C、D、E、F为前四周期的六种元素,原子序数依次增大,其相关信息如下:
请回答下列问题:
(1)F位于元素周期表第ⅠB族,其简化电子排布式为[Ar]3d104s1.
(2)D元素基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈哑铃形.
(3)某同学根据上述信息,推断E基态原子的核外电子排布图为: ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.
(4)A与D形成的D2A4分子中D原子的杂化类型为sp3杂化,A与D形成的最简单分子易溶于水的原因氨气分子能与水分子形成氢键.
(5)C的一种单质相对分子质量为720,分子构型为一个32面体,其中有12个五元环,20个六元环(如图1).则1个这种单质分子中所含π键的数目为30.
(6)已知在元素周期表中存在“对角线规则”,即周期表中左上方与右下方元素它们的单质及其化合物性质相似,如Li和Mg,试写出DCl2溶液中加入过量的NaOH溶液反应的化学方程式:BeCl2+4NaOH═Na2BeO2+2NaCl+2H2O.
(7)图2是金属Ca和F所形成的某种合金的晶胞结构示意图,已知铜镍合金与上述合金具有相同类型的晶胞结构XYa,它们有很强的储氢能力.已知铜镍合金LaNin晶胞体积为9.0×10-33cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=5(填数值);氢在合金中的密度为0.083g•cm-3.
| 相关信息 | |
| A | 所处的周期数、族序数分别与其原子序数相等 |
| B | 原子核外电子有4种不同的运动状态 |
| C | 元素原子的核外成对电子数是未成对电子数的2倍且有3个能级 |
| D | 元素原子的核外p电子数比s电子数少1 |
| E | E原子的第一至第四电离能如下: I1=738kJ•mol-1 I2=1451kJ•mol-1 I3=7733kJ•mol-1 I4=10540kJ•mol-1 |
| F | 第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满 |
(1)F位于元素周期表第ⅠB族,其简化电子排布式为[Ar]3d104s1.
(2)D元素基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈哑铃形.
(3)某同学根据上述信息,推断E基态原子的核外电子排布图为:
 ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.(4)A与D形成的D2A4分子中D原子的杂化类型为sp3杂化,A与D形成的最简单分子易溶于水的原因氨气分子能与水分子形成氢键.
(5)C的一种单质相对分子质量为720,分子构型为一个32面体,其中有12个五元环,20个六元环(如图1).则1个这种单质分子中所含π键的数目为30.
(6)已知在元素周期表中存在“对角线规则”,即周期表中左上方与右下方元素它们的单质及其化合物性质相似,如Li和Mg,试写出DCl2溶液中加入过量的NaOH溶液反应的化学方程式:BeCl2+4NaOH═Na2BeO2+2NaCl+2H2O.
(7)图2是金属Ca和F所形成的某种合金的晶胞结构示意图,已知铜镍合金与上述合金具有相同类型的晶胞结构XYa,它们有很强的储氢能力.已知铜镍合金LaNin晶胞体积为9.0×10-33cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=5(填数值);氢在合金中的密度为0.083g•cm-3.

12.已知A、B、C、D的原子序数都不超过18,.它们的离子aA(n+1)+、bBn+、cC(n+1)-、dDn- 均具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子序数:a>b>c>d | B. | 离子半径:A(n+1)+>Bn+>C(n+1)->Dn- | ||
| C. | 原子半径:A>B>C>D | D. | 单质还原性:B>A,单质氧化性:D>C |
6.橙花醛是一种香料,结构简式为:(CH3)2C=CHCH2CH2C(CH3)=CHCHO.下列说法正确的是( )
| A. | 橙花醛不可以与溴发生加成反应 | |
| B. | 1mol橙花醛最多可以与2mol氢气发生加成反应 | |
| C. | 橙花醛可以发生银镜反应,分子结构存在顺反异构 | |
| D. | 橙花醛是乙醛的同系物 |
13.下列关于同系物的叙述中不正确的是( )
| A. | 某有机物同系物组成可用通式CnH2n+2表示 | |
| B. | 同系物互为同分异构体 | |
| C. | 两个同系物之间相对分子质量相差14或14的整数倍 | |
| D. | 同系物具有相似的化学性质 |
10.下列化学反应属于吸热反应的是( )
| A. | NH4Cl与Ba(OH)2•8H2O研磨 | B. | 生石灰溶于水 | ||
| C. | 镁与稀盐酸反应 | D. | 甲烷燃烧 |
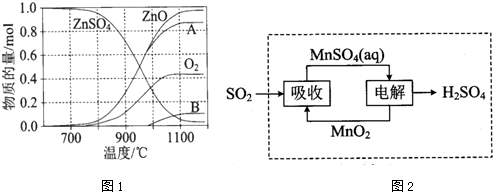
 .
.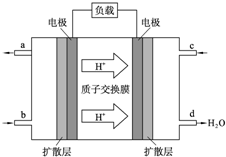 中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.
中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.