题目内容
8.化学平衡移动原理同样也适用于其他平衡,已知在氨水中存在下列平衡:NH3•H2O?NH4++OH-.①向氨水中加入MgCl2固体时,平衡向右移动,(填“向右”或“向左”),c(OH-)减小(填“增大”或“减小”,下同),c(NH4+)增大.
②向氨水中加入NH4Cl固体时,平衡向左移动,(填“向右”或“向左”),c(OH-)减小(填“增大”或“减小”,下同),c(NH4+)增大.
③升高温度,c(OH-)增大(填“增大”或“减小”,下同),c(NH4+)增大.
分析 ①向氨水中加入氯化镁固体时,镁离子和氢氧根离子反应生成氢氧化镁沉淀,促进一水合氨电离;
②向氨水中加入氯化铵固体时,铵根离子浓度增大,一水合氨的电离平衡逆向移动;
③升温促进一水合氨的电离.
解答 解:①向氨水中加入氯化镁固体时,镁离子和氢氧根离子反应生成氢氧化镁沉淀,氢氧根离子浓度减小,促进一水合氨电离,则溶液中铵根离子浓度增大,
故答案为:向右;减小;增大;
②向氨水中加入氯化铵固体时,铵根离子浓度增大,一水合氨的电离平衡逆向移动,氢氧根离子浓度减小,故答案为:向左;减小;增大;
③升温促进一水合氨的电离,氢氧根离子和铵根离子浓度都增大,故答案为:增大;增大.
点评 本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,再结合溶液中离子浓度变化确定平衡移动方向,题目难度不大.

练习册系列答案
相关题目
18.一定温度下,将2molA、2molB、2molC的气体混合物充入一体积不变密闭容器中,充分反应后恢复到起始温度,测得容器内的压强比起始时增大了20%,则容器中可能发生的反应是( )
| A. | 2A+B?2C | B. | A+B?2C | C. | 2A+B?C | D. | 2A+B?4C |
19.能正确表示下列反应的离子方程式是( )
| A. | Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O | |
| B. | Ca(HCO3)2溶液与过量NaOH溶液反应:HCO${\;}_{3}^{-}$+Ca2++OH-═CaCO3↓+H2O | |
| C. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO${\;}_{4}^{-}$+6H++5H2O2=2Mn2++5O2↑+8H2O | |
| D. | AlCl3溶液与过量的浓氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O |
16.下列与叙述不正确的是( )
| A. | 水蒸气变为液态水时,焓变△H<0 | |
| B. | 对于△H<0的反应,反应物的总焓大于生成物的总焓 | |
| C. | 需要持续加热才能进行的反应△H一定大于0 | |
| D. | Ba(OH)2•8H2O和NH4Cl固体反应,反应物的总键能小于生成物的总键能 |
3.化学中常用图象直观地描述化学反应的进程或结果.如图图象描述正确的是( )


| A. | 图①可表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| B. | 图②可表示对“2SO2(g)+O2(g)?2SO2 (g)△H<0”的平衡体系改变T、P后反应物转化率的变化 | |
| C. | 图③可表示使用催化剂对可逆反应C(s)+H2O(g)?CO(g)+H2(g)的影响 | |
| D. | 图④表示醋酸溶液中通入氨气至过量过程中溶液导电性的变化 |
13.下列与化学概念有关的说法正确的是( )
| A. | SiO2、P2O5、NO均为酸性氧化物 | |
| B. | NaH、NaBH4、NaClO均为离子化合物 | |
| C. | NH3.H2O是弱碱,所以NH4NO3为弱电解质 | |
| D. | 磁性氧化铁、水玻璃、液氨均为混合物 |
20.如表所示的五种元素中,W、X、Y、Z为短周期元素,W元素的核电荷数为X元素的2倍.下列说法错误的是
( )
( )
| X | Y | ||
| W | Z | ||
| T |
| A. | 气态氢化物稳定性:Z>W | |
| B. | 简单离子半径:X<Y | |
| C. | 液态WZ4气化需克服分子间作用力 | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性 |
18.下列说法或表示法正确的是( )
| A. | 需要加热的反应说明它是吸热反应 | |
| B. | 氢气与氧气反应生成等量的水蒸气和液态水,前者放出的热量多 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l),△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的稀硫酸与含1.1 mol NaOH的稀溶液混合,放出的热量等于 57.3 kJ | |
| D. | 1 mol S完全燃烧放热297.3 kJ,其热化学方程式为:S+O2═SO2△H=-297.3 kJ/mol |
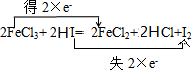 ,当有0.1mol的Fe2+生成时,转移电子数目为0.1NA.
,当有0.1mol的Fe2+生成时,转移电子数目为0.1NA.