题目内容
20.5.6g的铁加入到0.1mol/L,1L的稀盐酸中.在标况下生成氢气的体积和质量是多少?(Fe:56 H:1)分析 发生Fe+2HCl=FeCl2+H2↑,n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,n(HCl)=0.1mol/L×1L=0.1mol,结合反应及V=nVm、m=nM计算.
解答 解:n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,n(HCl)=0.1mol/L×1L=0.1mol,由Fe+2HCl=FeCl2+H2↑可知盐酸不足,则HCl完全反应,生成氢气为0.1mol×$\frac{1}{2}$=0.05mol,则标况下生成氢气的体积为0.05mol×22.4L/mol=1.12L,其质量为0.05mol×2g/mol=0.1g,
答:标况下生成氢气的体积为1.12L,质量为0.1g.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应、过量判断为解答的关键,侧重分析与计算能力的考查,注意物质的量计算的相关计算公式,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.C2H5OH、CH4、C3H8、C是常用的燃料,它们每1mol分别完全燃烧时,前三种生成CO2(g)及H2O(l),最后一种生成CO2(g),放出的热量依次为1366.8kJ、890.3kJ、2219.9kJ、393.5kJ.相同质量的这四种燃料,完全燃烧时放出热量最少的是( )
| A. | C2H5OH | B. | CH4 | C. | C3H8 | D. | C |
11.图中各装置,能组成原电池的是( )
| A. |  | B. |  | C. |  | D. |  |
15.下列关于实验的说法错误的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 检验CO2与NaOH溶液反应后 的溶液中是否有Na2CO3 | 取少量反应后的溶液,滴加BaC12溶液,看是否有沉淀生成 |
| B | 除去甲烷中含有的乙烯杂质 | 将气体通入到酸性高锰酸钾溶液后,再通过装有碱石灰的干燥管 |
| C | 证明酸性:H2CO3>H3BO3 | 向Na2CO3中滴入过量H3BO3溶液,无气泡冒出 |
| D | 分离Fe(OH)3胶体和FeCl3溶液 | 将混合液倒入过滤器中过滤 |
| A. | A | B. | B | C. | C | D. | D |
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 78 g苯含有的C=C键数目为3NA | |
| B. | lmol C10H20分子中共用电子对总数为31 NA | |
| C. | 1 L 1 mol•L-1苯酚钠溶液中含有  的个数为NA 的个数为NA | |
| D. | 1mol甲烷与足量氧气发生反应,转移电子数为8 NA |
12.下列说法不正确的是( )
| A. | 麦芽糖及其水解产物均能发生银镜反应 | |
| B. | 用溴水即可鉴别苯酚溶液、2,4-己二烯和甲苯 | |
| C. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| D. | 用甘氨酸( 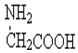 )和丙氨酸( )和丙氨酸( 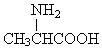 )缩合最多可形成4种二肽(不考虑形成环状) )缩合最多可形成4种二肽(不考虑形成环状) |
9.现有三组混合液:
①乙酸乙酯和乙酸钠溶液;
②乙醇和丁醇;
③NaBr和单质Br2的水溶液.
分离以上各混合液的正确方法依次是( )
①乙酸乙酯和乙酸钠溶液;
②乙醇和丁醇;
③NaBr和单质Br2的水溶液.
分离以上各混合液的正确方法依次是( )
| A. | 分液、蒸馏、萃取 | B. | 萃取、蒸馏、分液 | C. | 分液、萃取、蒸馏 | D. | 蒸馏、萃取、分液 |
10.下列叙述中正确的是( )
| A. | 由乙酸和乙醇生成乙酸乙酯的反应类型和由溴乙烷生成乙烯的反应类型相同 | |
| B. | 醇、油脂和蛋白质均能发生水解反应 | |
| C. | 丙烯在一定条件下可与溴水发生加成反应生成1,2-二溴丙烷 | |
| D. | 甲苯与氯气在光照下发生取代反应主要生成2,4二氯甲苯 |