题目内容
9.现有三组混合液:①乙酸乙酯和乙酸钠溶液;
②乙醇和丁醇;
③NaBr和单质Br2的水溶液.
分离以上各混合液的正确方法依次是( )
| A. | 分液、蒸馏、萃取 | B. | 萃取、蒸馏、分液 | C. | 分液、萃取、蒸馏 | D. | 蒸馏、萃取、分液 |
分析 ①甲酸乙酯和乙酸钠,分层;
②乙醇和丁醇互溶,但沸点不同;
③单质溴不易溶于水,易溶于有机溶剂,以此来解答.
解答 解:①甲酸乙酯和乙酸钠,分层,选择分液法分离;
②乙醇和丁醇互溶,但沸点不同,选择蒸馏法分离;
③单质溴不易溶于水,易溶于有机溶剂,选择萃取法分离,
故选A.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.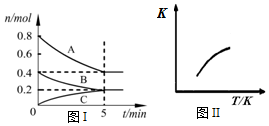 固定容积为2L的密闭容器中发生反应xA(g)+yB(g)?zC(g),图I表示200℃时容器中各物质的量随时间的变化关系,图II表示平衡时平衡常数K随温度变化的关系.结合图象判断,下列结论正确的是( )
固定容积为2L的密闭容器中发生反应xA(g)+yB(g)?zC(g),图I表示200℃时容器中各物质的量随时间的变化关系,图II表示平衡时平衡常数K随温度变化的关系.结合图象判断,下列结论正确的是( )
 固定容积为2L的密闭容器中发生反应xA(g)+yB(g)?zC(g),图I表示200℃时容器中各物质的量随时间的变化关系,图II表示平衡时平衡常数K随温度变化的关系.结合图象判断,下列结论正确的是( )
固定容积为2L的密闭容器中发生反应xA(g)+yB(g)?zC(g),图I表示200℃时容器中各物质的量随时间的变化关系,图II表示平衡时平衡常数K随温度变化的关系.结合图象判断,下列结论正确的是( )| A. | 200℃时,反应从开始到平衡的平均速率v(A)=0.08 mol•L-1•min-1 | |
| B. | 200℃时,若在第6 min再向体系中充入1 mol He,此时v(正)>v(逆) | |
| C. | 若0~5 min内容器与外界的热交换总量为m kJ,则该反应的热化学方程式可表示为:2A(g)+B(g)?C(g)△H=+5m kJ/mol | |
| D. | 200℃时,平衡后再充入2 mol C,则再次达到平衡时,C的体积分数等于0.25 |
17.我国稀土资源丰富,下列有关稀土元素${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm的说法正确的是( )
| A. | ${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm是同一种核素 | |
| B. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm的质量数相同 | |
| C. | ${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm互为同位素 | |
| D. | ${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm的核外电子数和中子数均为62 |
4.在恒温容积为2L的密闭容器中进行反应N2(g)+3H2(g)?2NH3(g),若氨气的物质的量由0.4mol降到0.24mol需2s,那么由0.24mol降到0.04mol,需要的反应时间为( )
| A. | 等于2.5s | B. | 等于2.0s | C. | 大于2.5s | D. | 小于2.0s |
14.生产、生活离不开各种化学物质,下列说法不正确的是( )
| A. | 维生素C昜被氧化,当新鲜蔬菜煮熟后,所含维生素C会有所损失 | |
| B. | 钢筋混凝土属复合材料 | |
| C. | 光导纤维和计算机芯片的主要材料都是单质硅 | |
| D. | 生产水泥、玻璃、熟石灰都要用到石灰石这一原料 |
1.同在室温下,同种规格的铝片分别与下列物质混合,反应速率最大的是( )
| A. | 0.1mol/L的HCl 95mL | B. | 0.2mol/L的HCl 90mL | ||
| C. | 0.15mol/L的H2SO410mL | D. | 18mol/L的H2SO485mL |
18.下列化合物沸点比较错误的是( )
| A. | 丙烷>乙烷>甲烷 | B. | 邻二甲苯>间二甲苯>对二甲苯 | ||
| C. | 正戊烷>异戊烷>新戊烷 | D. | 对二甲苯>邻二甲苯>间二甲苯 |
19.常温常压下,下列化合物以液态形式存在的是( )
| A. | 乙烷 | B. | 丙烯 | C. | 乙醇 | D. | 丙炔 |