题目内容
8.同温同压下的C18O气体和2H2,若体积相同时,两种气体的质量比15:2,其密度比为15:2;若质量相等时,两种气体的体积比为2:15.分析 同温同压下,气体摩尔体积相等,如果C18O和2H2的体积相等,则二者的物质的量相等,根据m=nM、ρ=$\frac{M}{V{\;}_{m}}$计算其质量之比、密度之比,如果二者质量相等,根据V=$\frac{m}{M}$Vm计算其体积之比.
解答 解:同温同压下,气体摩尔体积相等,如果C18O和2H2的体积相等,则二者的物质的量相等,C18O的摩尔质量是30g/mol、2H2的摩尔质量是4g/mol,根据m=nM知,相同物质的量时,二者的质量之比等于其摩尔质量之比,为30g/mol:4g/mol=15:2;
根据ρ=$\frac{M}{V{\;}_{m}}$知,气体摩尔体积相等时,二者的密度之比等于其摩尔质量之比=30g/mol:4g/mol=15:2;
如果二者质量相等,根据V=$\frac{m}{M}$Vm知,相同气体摩尔体积时,其体积之比等于摩尔质量的反比=4g/mol:30g/mol=2:15,
故答案为:15:2;15:2;2:15.
点评 本题考查物质的量的计算,为基础性习题,把握质量、物质的量、摩尔质量的关系为解答的关键,侧重分析能力和计算能力的考查,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18. (1)科学家寻找高效催化剂,通过如下反应实现大气污染物转化:
(1)科学家寻找高效催化剂,通过如下反应实现大气污染物转化:
2CO(g)+2NO(g)?N2(g)+2CO2(g)△H1
已知:CO燃烧热△H2=-283kj/mol
N2(g)+O2(g)=2NO(g)△H3
几种化学键的键能数据如表一:
表一:
上述△H3=+183kJ•moL-1,△H1=-749kJ•moL-1.
(2)NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划.在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行下述反应I,测得不同时间的NH3和O2的浓度如表:
表二:
则下列有关叙述中正确的是AD
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4υ正(NH3)=6υ逆(H2O)时,说明反应已达平衡
C.当容器内$\frac{n(NO)}{n(N{H}_{3})}$=1时,说明反应已达平衡
D.前10分钟内的平均速率υ(NO)=0.088mol•L-1•min-1
(3)氨催化氧化时会发生下述两个竞争反应I、II.催化剂常具有较强的选择性,即专一性.已知:反应I:4NH3(g)+5O2(g)$?_{高温}^{Pt/Ru}$ 4NO(g)+6H2O(g)
反应II:4NH3(g)+3O2(g)$?_{高温}^{Cu/TiO_{2}}$ 2N2(g)+6H2O(g)
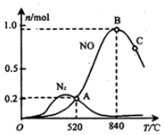
为分析某催化剂对该反应的选择性,在1L密闭容器中充入1mol NH3和2mol O2,测得有关物质的量关系如图:
①该催化剂在高温时选择反应I(填“I”或“II”).
②520℃时,4NH3+3O2?2N2+6H2O的平衡常数K=$\frac{0.{2}^{4}×0.{9}^{6}}{0.{4}^{4}×1.4{5}^{5}}$(不要求得出计算结果,只需列出数字计算式).
③由图象可判断,反应I正反应△H<0(填“>”、“<”或“=”)
④C点比B点所产生的NO的物质的量少的主要原因升高温度平衡逆向移动.
(4)羟胺(NH2OH)的电子式 ,羟胺是一种还原剂,现用25.00mL 0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是N2O.
,羟胺是一种还原剂,现用25.00mL 0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是N2O.
 (1)科学家寻找高效催化剂,通过如下反应实现大气污染物转化:
(1)科学家寻找高效催化剂,通过如下反应实现大气污染物转化:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H1
已知:CO燃烧热△H2=-283kj/mol
N2(g)+O2(g)=2NO(g)△H3
几种化学键的键能数据如表一:
表一:
| 化学键 | N≡N | O=O | NO中氮氧键 |
| 键能(kJ/mol) | 945 | 498 | 630 |
(2)NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划.在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行下述反应I,测得不同时间的NH3和O2的浓度如表:
表二:
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
| c(NH3)/mol•L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.0072 | 0.0072 |
| c(O2)/mol•L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4υ正(NH3)=6υ逆(H2O)时,说明反应已达平衡
C.当容器内$\frac{n(NO)}{n(N{H}_{3})}$=1时,说明反应已达平衡
D.前10分钟内的平均速率υ(NO)=0.088mol•L-1•min-1
(3)氨催化氧化时会发生下述两个竞争反应I、II.催化剂常具有较强的选择性,即专一性.已知:反应I:4NH3(g)+5O2(g)$?_{高温}^{Pt/Ru}$ 4NO(g)+6H2O(g)
反应II:4NH3(g)+3O2(g)$?_{高温}^{Cu/TiO_{2}}$ 2N2(g)+6H2O(g)
为分析某催化剂对该反应的选择性,在1L密闭容器中充入1mol NH3和2mol O2,测得有关物质的量关系如图:
①该催化剂在高温时选择反应I(填“I”或“II”).
②520℃时,4NH3+3O2?2N2+6H2O的平衡常数K=$\frac{0.{2}^{4}×0.{9}^{6}}{0.{4}^{4}×1.4{5}^{5}}$(不要求得出计算结果,只需列出数字计算式).
③由图象可判断,反应I正反应△H<0(填“>”、“<”或“=”)
④C点比B点所产生的NO的物质的量少的主要原因升高温度平衡逆向移动.
(4)羟胺(NH2OH)的电子式
 ,羟胺是一种还原剂,现用25.00mL 0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是N2O.
,羟胺是一种还原剂,现用25.00mL 0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是N2O.
19.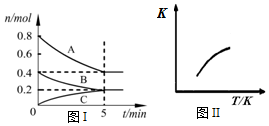 固定容积为2L的密闭容器中发生反应xA(g)+yB(g)?zC(g),图I表示200℃时容器中各物质的量随时间的变化关系,图II表示平衡时平衡常数K随温度变化的关系.结合图象判断,下列结论正确的是( )
固定容积为2L的密闭容器中发生反应xA(g)+yB(g)?zC(g),图I表示200℃时容器中各物质的量随时间的变化关系,图II表示平衡时平衡常数K随温度变化的关系.结合图象判断,下列结论正确的是( )
 固定容积为2L的密闭容器中发生反应xA(g)+yB(g)?zC(g),图I表示200℃时容器中各物质的量随时间的变化关系,图II表示平衡时平衡常数K随温度变化的关系.结合图象判断,下列结论正确的是( )
固定容积为2L的密闭容器中发生反应xA(g)+yB(g)?zC(g),图I表示200℃时容器中各物质的量随时间的变化关系,图II表示平衡时平衡常数K随温度变化的关系.结合图象判断,下列结论正确的是( )| A. | 200℃时,反应从开始到平衡的平均速率v(A)=0.08 mol•L-1•min-1 | |
| B. | 200℃时,若在第6 min再向体系中充入1 mol He,此时v(正)>v(逆) | |
| C. | 若0~5 min内容器与外界的热交换总量为m kJ,则该反应的热化学方程式可表示为:2A(g)+B(g)?C(g)△H=+5m kJ/mol | |
| D. | 200℃时,平衡后再充入2 mol C,则再次达到平衡时,C的体积分数等于0.25 |
16.五种短周期主族元素A、B、C、D、E的原子序数依次增大,A2属于绿色燃料,C的氧化物用于生产光导纤维,D元素原子的核电荷数是同主族上一周期元素的2倍,B、C为同周期元素,B、D原子最外层电子数之和等于E的最外层电子数. 根据以上叙述,下列说法中正确的是( )
| A. | 五种元素中有两种金属元素 | |
| B. | 元素C、D、E的最高价氧化物对应水化物的酸性增强 | |
| C. | 元素D、E分别与元素A形成化合物的稳定性:A2D>AE | |
| D. | 元素B、D、E的简单离子半径大小为:B>D>E |
3.下列橡胶产品中属特种橡胶的是( )
| A. | 丁苯橡胶 | B. | 顺丁橡胶 | C. | 氯丁橡胶 | D. | 聚硫橡胶 |
13.下列有关有机物的说法正确的是( )
| A. | 日常生活中常见的聚乙烯、聚氯乙烯、聚四氟乙烯都可以通过加聚反应得到 | |
| B. | 等质量CH4和C4H8分别在氧气中完全燃烧,CH4的耗氧量小于C4H8 | |
| C. | 苯与溴水混合,反复振荡后溴水层褪色,这是由于发生了取代反应 | |
| D. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
17.我国稀土资源丰富,下列有关稀土元素${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm的说法正确的是( )
| A. | ${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm是同一种核素 | |
| B. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm的质量数相同 | |
| C. | ${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm互为同位素 | |
| D. | ${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm的核外电子数和中子数均为62 |
18.下列化合物沸点比较错误的是( )
| A. | 丙烷>乙烷>甲烷 | B. | 邻二甲苯>间二甲苯>对二甲苯 | ||
| C. | 正戊烷>异戊烷>新戊烷 | D. | 对二甲苯>邻二甲苯>间二甲苯 |