题目内容
10.C2H5OH、CH4、C3H8、C是常用的燃料,它们每1mol分别完全燃烧时,前三种生成CO2(g)及H2O(l),最后一种生成CO2(g),放出的热量依次为1366.8kJ、890.3kJ、2219.9kJ、393.5kJ.相同质量的这四种燃料,完全燃烧时放出热量最少的是( )| A. | C2H5OH | B. | CH4 | C. | C3H8 | D. | C |
分析 由每1mol分别完全燃烧时的热量,$\frac{Q}{M}$越小时,相同质量的燃料,完全燃烧时放出热量越少,以此来解答.
解答 解:C2H5OH、CH4、C3H8、C各1mol分别完全燃烧时,放出的热量依次为1366.8kJ、890.3kJ、2219.9kJ、393.5kJ,
则$\frac{1366.8}{46}$=29.71、$\frac{890.6}{16}$=55.66、$\frac{2219.9}{44}$=50.45、$\frac{393.5}{12}$=32.79中,只有29.71最小,可知相同质量的这四种燃料,完全燃烧时放出热量最少的是C2H5OH,
故选A.
点评 本题考查热化学反应,为高频考点,把握反应中能量变化、燃烧热的应用为解答的关键,侧重分析与应用能力的考查,注意单位质量与物质的量的区别,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.化学与材料、生活和环境密切相关.下列有关说法中正确的是( )
| A. | 煤炭经蒸馏、气化和液化等过程,可获得清洁能源和重要的化工原料 | |
| B. | 医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性 | |
| C. | “海水淡化”可以解决淡水供应危机,向海水中加入明矾可以使海水淡化 | |
| D. | 新型材料聚酯纤维、光导纤维都属于有机高分子化合物 |
1.下列各组离子一定能大量共存的是( )
| A. | 在强碱溶液中:Na+.K+.AlO2-.CO32- | |
| B. | 在含大量Fe3+的溶液中:NH4+.Na+.Cl-.SCN- | |
| C. | 在c(H+)=10-13mol/L 的溶液中:NH4+.Al3+.SO42-.NO3- | |
| D. | 在pH=1的溶液中:K+.Fe2+.Cl-.NO3- |
18. (1)科学家寻找高效催化剂,通过如下反应实现大气污染物转化:
(1)科学家寻找高效催化剂,通过如下反应实现大气污染物转化:
2CO(g)+2NO(g)?N2(g)+2CO2(g)△H1
已知:CO燃烧热△H2=-283kj/mol
N2(g)+O2(g)=2NO(g)△H3
几种化学键的键能数据如表一:
表一:
上述△H3=+183kJ•moL-1,△H1=-749kJ•moL-1.
(2)NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划.在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行下述反应I,测得不同时间的NH3和O2的浓度如表:
表二:
则下列有关叙述中正确的是AD
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4υ正(NH3)=6υ逆(H2O)时,说明反应已达平衡
C.当容器内$\frac{n(NO)}{n(N{H}_{3})}$=1时,说明反应已达平衡
D.前10分钟内的平均速率υ(NO)=0.088mol•L-1•min-1
(3)氨催化氧化时会发生下述两个竞争反应I、II.催化剂常具有较强的选择性,即专一性.已知:反应I:4NH3(g)+5O2(g)$?_{高温}^{Pt/Ru}$ 4NO(g)+6H2O(g)
反应II:4NH3(g)+3O2(g)$?_{高温}^{Cu/TiO_{2}}$ 2N2(g)+6H2O(g)
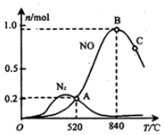
为分析某催化剂对该反应的选择性,在1L密闭容器中充入1mol NH3和2mol O2,测得有关物质的量关系如图:
①该催化剂在高温时选择反应I(填“I”或“II”).
②520℃时,4NH3+3O2?2N2+6H2O的平衡常数K=$\frac{0.{2}^{4}×0.{9}^{6}}{0.{4}^{4}×1.4{5}^{5}}$(不要求得出计算结果,只需列出数字计算式).
③由图象可判断,反应I正反应△H<0(填“>”、“<”或“=”)
④C点比B点所产生的NO的物质的量少的主要原因升高温度平衡逆向移动.
(4)羟胺(NH2OH)的电子式 ,羟胺是一种还原剂,现用25.00mL 0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是N2O.
,羟胺是一种还原剂,现用25.00mL 0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是N2O.
 (1)科学家寻找高效催化剂,通过如下反应实现大气污染物转化:
(1)科学家寻找高效催化剂,通过如下反应实现大气污染物转化:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H1
已知:CO燃烧热△H2=-283kj/mol
N2(g)+O2(g)=2NO(g)△H3
几种化学键的键能数据如表一:
表一:
| 化学键 | N≡N | O=O | NO中氮氧键 |
| 键能(kJ/mol) | 945 | 498 | 630 |
(2)NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划.在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行下述反应I,测得不同时间的NH3和O2的浓度如表:
表二:
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
| c(NH3)/mol•L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.0072 | 0.0072 |
| c(O2)/mol•L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4υ正(NH3)=6υ逆(H2O)时,说明反应已达平衡
C.当容器内$\frac{n(NO)}{n(N{H}_{3})}$=1时,说明反应已达平衡
D.前10分钟内的平均速率υ(NO)=0.088mol•L-1•min-1
(3)氨催化氧化时会发生下述两个竞争反应I、II.催化剂常具有较强的选择性,即专一性.已知:反应I:4NH3(g)+5O2(g)$?_{高温}^{Pt/Ru}$ 4NO(g)+6H2O(g)
反应II:4NH3(g)+3O2(g)$?_{高温}^{Cu/TiO_{2}}$ 2N2(g)+6H2O(g)
为分析某催化剂对该反应的选择性,在1L密闭容器中充入1mol NH3和2mol O2,测得有关物质的量关系如图:
①该催化剂在高温时选择反应I(填“I”或“II”).
②520℃时,4NH3+3O2?2N2+6H2O的平衡常数K=$\frac{0.{2}^{4}×0.{9}^{6}}{0.{4}^{4}×1.4{5}^{5}}$(不要求得出计算结果,只需列出数字计算式).
③由图象可判断,反应I正反应△H<0(填“>”、“<”或“=”)
④C点比B点所产生的NO的物质的量少的主要原因升高温度平衡逆向移动.
(4)羟胺(NH2OH)的电子式
 ,羟胺是一种还原剂,现用25.00mL 0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是N2O.
,羟胺是一种还原剂,现用25.00mL 0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是N2O.
5.回答下列相关问题:
(1)用“>”或“<”填写表:
(2)某半导体材料由X、Y两种元素组成,已知X的基态原子4p轨道上只有1个电子,Y的基态原子L层上有3个未成对电子.X位于周期表第四周期IIIA族;该半导体材料的化学式为GaN
(3)由极性共价键构成的非极性分子是d(填序号).
a.P4b.COS c.CH3OCH3 d.BCl3
(4)雷氏盐(Reinecke's salt)结构式如图所示:
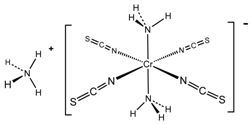
配离子中Cr3+的配体为NH3和NCS-(填化学式),Cr3+与配体间形成的共价键又称为配位键.
(1)用“>”或“<”填写表:
| 电负性 | 第一电离能 | 熔点 | 沸点(同压) | 在水中溶解性 |
| C>H | S<P | NaF>KCl | PH3<NH3 | CH3OH>CH3SH |
(3)由极性共价键构成的非极性分子是d(填序号).
a.P4b.COS c.CH3OCH3 d.BCl3
(4)雷氏盐(Reinecke's salt)结构式如图所示:

配离子中Cr3+的配体为NH3和NCS-(填化学式),Cr3+与配体间形成的共价键又称为配位键.
19. 固定容积为2L的密闭容器中发生反应xA(g)+yB(g)?zC(g),图I表示200℃时容器中各物质的量随时间的变化关系,图II表示平衡时平衡常数K随温度变化的关系.结合图象判断,下列结论正确的是( )
固定容积为2L的密闭容器中发生反应xA(g)+yB(g)?zC(g),图I表示200℃时容器中各物质的量随时间的变化关系,图II表示平衡时平衡常数K随温度变化的关系.结合图象判断,下列结论正确的是( )
 固定容积为2L的密闭容器中发生反应xA(g)+yB(g)?zC(g),图I表示200℃时容器中各物质的量随时间的变化关系,图II表示平衡时平衡常数K随温度变化的关系.结合图象判断,下列结论正确的是( )
固定容积为2L的密闭容器中发生反应xA(g)+yB(g)?zC(g),图I表示200℃时容器中各物质的量随时间的变化关系,图II表示平衡时平衡常数K随温度变化的关系.结合图象判断,下列结论正确的是( )| A. | 200℃时,反应从开始到平衡的平均速率v(A)=0.08 mol•L-1•min-1 | |
| B. | 200℃时,若在第6 min再向体系中充入1 mol He,此时v(正)>v(逆) | |
| C. | 若0~5 min内容器与外界的热交换总量为m kJ,则该反应的热化学方程式可表示为:2A(g)+B(g)?C(g)△H=+5m kJ/mol | |
| D. | 200℃时,平衡后再充入2 mol C,则再次达到平衡时,C的体积分数等于0.25 |



