题目内容
15.10.0gMg与过量的盐酸反应生成氯化镁,反应完全后,回收得到30.8g氯化镁,请问产率是多少?分析 根据关系式Mg~~MgCl2,求10.0gMg与过量盐酸反应理论上生成氯化镁的质量,然后结合产率$\frac{实际质量}{理论质量}×100%$,由此解答.
解答 解:Mg~~MgCl2,
24 95
10.0g m
所以m=$\frac{95×10}{24}$=39.58g,所以产率是$\frac{30.8g}{39.58g}×100%$=77.8%,答:产率是77.8%.
点评 本题考查化学方程式进行计算的题目,学生只要根据反应列出关系式就可以迅速解题,试题培养学生的化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.有关氧元素及含氧物质表示正确的是 ( )
| A. | 质子数为8、中子数为10的氧原子:${\;}_{8}^{10}$O | |
| B. | 氧离子(O2-)的结构示意图: | |
| C. | 某氧单质的球棍模型: | |
| D. | 某碳氧化合物电子式: |
3.NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| B. | 1molFeI2与足量氯气反应时转移的电子数为2NA | |
| C. | 1mol烃基与17gNH3所含电子数之比为9:10 | |
| D. | 一定温度下1L0.5mol/LNH4Cl溶液与2L0.25mol/LNH4Cl含NH4+的物质的量相同 |
10.恒温下,下列各组离子在指定溶液中-定能大量共存的是( )
| A. | 与铝反应产生氢气的溶液中:Na+、NH4+、SO42-、CH3C00- | |
| B. | c(Fe3+)=0.1mol•L-1的溶液中:NH4+、Cl-、AlO2-、SO42- | |
| C. | 使甲基橙变红的溶液中:K+、Al3+、SO42-、NO3- | |
| D. | 由水电离出的c(OH-)=10-13mol•L-1的溶液中:Na+、Ba2+、Cl-、I- |
20.下列物质中,不能使酚酞溶液变红的是( )
| A. | NH3 | B. | Na2SiO3 | C. | NaHCO3 | D. | Al(OH)3 |
7.分子式为C5H10O2的有机物,且只含一个官能团的所有同分异构体(不考虑立体异构)的数目为( )
| A. | 7种 | B. | 9种 | C. | 11种 | D. | 13种 |
9.下表中的数据是破坏1 mol化学键所消耗的能量.
根据上述数据回答(1)~(4)题.
(1)下列物质本身具有的能量最低的是A
A.H2 B.Cl2
C.Br2 D.I2
(2)下列氢化物中,最稳定的是A
A.HF B.HCl
C.HBr D.HI
(3)X2+H2═2HX(X代表F、Cl、Br)的反应是吸热反应还是放热反应:放热反应.
(4)相同条件下,X2(X代表F、Cl、Br)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是氟气.
| 物质 | Cl2 | Br2 | I2 | H2 | HF | HCl | HBr | HI |
| 能量(kJ) | 243 | 193 | 151 | 436 | 565 | 431 | 363 | 297 |
(1)下列物质本身具有的能量最低的是A
A.H2 B.Cl2
C.Br2 D.I2
(2)下列氢化物中,最稳定的是A
A.HF B.HCl
C.HBr D.HI
(3)X2+H2═2HX(X代表F、Cl、Br)的反应是吸热反应还是放热反应:放热反应.
(4)相同条件下,X2(X代表F、Cl、Br)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是氟气.
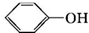
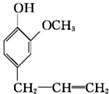 )可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下:
)可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下: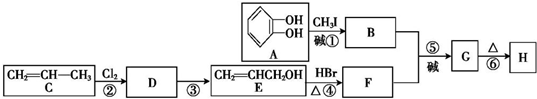
 +RX$\stackrel{碱}{→}$
+RX$\stackrel{碱}{→}$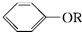 +HX(X代表卤素原子);
+HX(X代表卤素原子);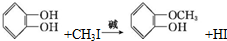 .
. .
.