题目内容
1.已知3NO2+H2O═2HNO3+NO,则被氧化和被还原的氮原子个数比为( )| A. | 2:1 | B. | 1:2 | C. | 1:1 | D. | 3:2 |
分析 在3NO2+H2O═2HNO3+NO的反应中,氮元素由+4价升高为+5价,被氧化;氮元素由+4价降低为+2价,被还原,根据电子转移守恒,判断被氧化的氮原子与被还原的氮原子数之比.
解答 解:在3NO2+H2O═2HNO3+NO的反应中,氮元素由+4价升高为+5价,被氧化;氮元素由+4价降低为+2价,被还原,
根据电子转移守恒,可知被氧化的氮原子与被还原的氮原子物质的量之比为(4-2):(5-4)=2:1,
故选A.
点评 本题考查氧化还原反应基本概念与计算,侧重学生的分析、计算能力的考查,难度中等,关键根据化合价变化判断氧化剂与还原剂,再根据电子转移守恒判断被氧化的氮原子与被还原的氮原子物质的量之比.

练习册系列答案
相关题目
7.分子式为C5H10O2的有机物,且只含一个官能团的所有同分异构体(不考虑立体异构)的数目为( )
| A. | 7种 | B. | 9种 | C. | 11种 | D. | 13种 |
9.下表中的数据是破坏1 mol化学键所消耗的能量.
根据上述数据回答(1)~(4)题.
(1)下列物质本身具有的能量最低的是A
A.H2 B.Cl2
C.Br2 D.I2
(2)下列氢化物中,最稳定的是A
A.HF B.HCl
C.HBr D.HI
(3)X2+H2═2HX(X代表F、Cl、Br)的反应是吸热反应还是放热反应:放热反应.
(4)相同条件下,X2(X代表F、Cl、Br)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是氟气.
| 物质 | Cl2 | Br2 | I2 | H2 | HF | HCl | HBr | HI |
| 能量(kJ) | 243 | 193 | 151 | 436 | 565 | 431 | 363 | 297 |
(1)下列物质本身具有的能量最低的是A
A.H2 B.Cl2
C.Br2 D.I2
(2)下列氢化物中,最稳定的是A
A.HF B.HCl
C.HBr D.HI
(3)X2+H2═2HX(X代表F、Cl、Br)的反应是吸热反应还是放热反应:放热反应.
(4)相同条件下,X2(X代表F、Cl、Br)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是氟气.
6.NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| C. | 2L0.5mol/L亚硫酸溶液中含有的氢离子数为2NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
13. CO和NO对环境影响较大,属于当今社会热点问题.请回答下列问题
CO和NO对环境影响较大,属于当今社会热点问题.请回答下列问题
(1)降低汽车尾气的反应:2NO(g)+2CO(g)═N2(g)+2CO2(g)若NO中的键能是632kJ/mol,CO中的键能是1072kJ/mol,CO2中C=O的键的键能为750kJ/mol,N2中的键能是946kJ/mol,则该反应的△H=-538KJ/mol
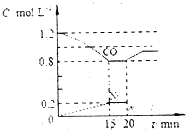
(2)若在一定温度下,将1.4molNO、1.2molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示
①该反应的平衡常数K=0.05 L•mol-1
②若保持温度不变,20min时再向容器中冲入CO、N2各0.8mol,平衡将向向左移动(填“向左”“向右”或“不”)
③20min时,若改变反应条件,导致CO浓度发生如图所示的变化,则改变的条件可能 是bc(填序号)
a.缩小容器体积 b.增加CO2的量 c.升高温度 d.加入催化剂
(3)固氮是科学家致力研究的重要课题,自然界中存在天然的大气固氮过程:N2(g)+O2(g)→2NO (g)-180.8kJ,工业合成氨则是人工固氮.
分析两种固氮反应的平衡常数,下列结论正确的是CD.
A.常温下,大气固氮很难进行,而工业固氮却能非常容易进行
B.K越大说明合成氨反应的速率越大
C.工业固氮时温度越低,氮气与氢气反应越完全
D.模拟大气固氮应用于工业上的意义不大.
 CO和NO对环境影响较大,属于当今社会热点问题.请回答下列问题
CO和NO对环境影响较大,属于当今社会热点问题.请回答下列问题(1)降低汽车尾气的反应:2NO(g)+2CO(g)═N2(g)+2CO2(g)若NO中的键能是632kJ/mol,CO中的键能是1072kJ/mol,CO2中C=O的键的键能为750kJ/mol,N2中的键能是946kJ/mol,则该反应的△H=-538KJ/mol
(2)若在一定温度下,将1.4molNO、1.2molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示
①该反应的平衡常数K=0.05 L•mol-1
②若保持温度不变,20min时再向容器中冲入CO、N2各0.8mol,平衡将向向左移动(填“向左”“向右”或“不”)
③20min时,若改变反应条件,导致CO浓度发生如图所示的变化,则改变的条件可能 是bc(填序号)
a.缩小容器体积 b.增加CO2的量 c.升高温度 d.加入催化剂
(3)固氮是科学家致力研究的重要课题,自然界中存在天然的大气固氮过程:N2(g)+O2(g)→2NO (g)-180.8kJ,工业合成氨则是人工固氮.
分析两种固氮反应的平衡常数,下列结论正确的是CD.
| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
B.K越大说明合成氨反应的速率越大
C.工业固氮时温度越低,氮气与氢气反应越完全
D.模拟大气固氮应用于工业上的意义不大.

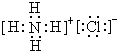
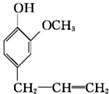 )可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下:
)可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下: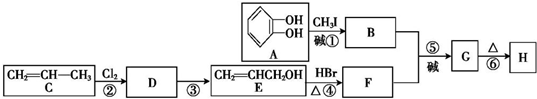
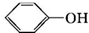 +RX$\stackrel{碱}{→}$
+RX$\stackrel{碱}{→}$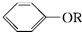 +HX(X代表卤素原子);
+HX(X代表卤素原子);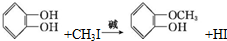 .
. .
.