题目内容
前四周期的A、B、C、D四种元素在周期表中均与元素X紧密相邻.已知元素X最高价氧化物的化学式为X2O5,B、D同主族且B元素的原子半径是同族元素中最小的,C的最高价氧化物对应的水化物是强酸.
(1)D元素基态原子的电子排布式为 .
(2)A、C、X三种元素原子的第一电离能由大到小的顺序为 (用相应的元素符号作答).
(3)B、X、D氢化物的沸点由高到低的顺序为 (用相应的化学式作答).
(4)E元素是A元素所在周期中电负性最大的,试推测下列微粒的立体构型:
根据结构与性质的关系,解释上述两种离子对应酸酸性强弱的原因 .
(5)元素B的一种氢化物B2H4具有重要的用途.有关B2H4的说法正确的是 .(选填字母)
A.B2H4分子间可形成氢键
B.B原子是sp3杂化
C.B2H4分子中含有5个σ键和1个π键
D.B2H4晶体变为液态时破坏共价键
(6)F元素基态原子M层上有5对成对电子,请解释F晶体能导电的原因 .F形成的单质有δ、γ、α三种同素异形体,三种晶胞(如下图所示)中F原子的配位数之比为 ,δ、γ、α三种晶胞的边长之比为 .

(1)D元素基态原子的电子排布式为
(2)A、C、X三种元素原子的第一电离能由大到小的顺序为
(3)B、X、D氢化物的沸点由高到低的顺序为
(4)E元素是A元素所在周期中电负性最大的,试推测下列微粒的立体构型:
| 微粒 | EO2- | EO3- |
| 立体构型名称 |
(5)元素B的一种氢化物B2H4具有重要的用途.有关B2H4的说法正确的是
A.B2H4分子间可形成氢键
B.B原子是sp3杂化
C.B2H4分子中含有5个σ键和1个π键
D.B2H4晶体变为液态时破坏共价键
(6)F元素基态原子M层上有5对成对电子,请解释F晶体能导电的原因

考点:位置结构性质的相互关系应用
专题:有机物的化学性质及推断
分析:元素X最高价氧化物的化学式为X2O5,则X为第ⅤA族元素,前四周期的A、B、C、D均与元素X紧密相邻,即位于X的四周,则A、B、C、D位于元素周期表的第二、三、四周期,X为磷元素,B、D同主族且B元素的原子半径是同族元素中最小的,B、X、D同主族,则B为氮元素,D为砷元素,C的最高价氧化物对应的水化物是强酸,C为硫元素,A为硅元素,F元素基态原子M层上有5对成对电子,则F的核外电子排布式为1s22s22p63s23p63d64s2,所以F为铁元素,据此答题.
解答:
解:元素X最高价氧化物的化学式为X2O5,则X为第ⅤA族元素,前四周期的A、B、C、D均与元素X紧密相邻,即位于X的四周,则A、B、C、D位于元素周期表的第二、三、四周期,X为磷元素,B、D同主族且B元素的原子半径是同族元素中最小的,B、X、D同主族,则B为氮元素,D为砷元素,C的最高价氧化物对应的水化物是强酸,C为硫元素,A为硅元素,F元素基态原子M层上有5对成对电子,则F的核外电子排布式为1s22s22p63s23p63d64s2,所以F为铁元素,
(1)D是砷元素,原子序数为33,其基态原子的电子排布式为1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3,故答案为:1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3;
(2)A、C、X分别为Si、S、P,根据元素周期律,同周期元素从左向右,第一电离逐渐增大,但第ⅡA族和第ⅤA族由于最外层处于全满和半满状态,第一电离能高于相邻族的元素,所以Si、S、P的第一电离能大小顺序为P>S>Si,故答案为:P>S>Si;
(3)B、X、D氢化物分别为NH3、PH3、AsH3,因为氨分子之间有氢键的存在,所以氨的沸点较大,则AsH3>的相对分子质量大于PH3,所以沸点也高于PH3,所以它们的沸点由高到低的顺序为NH3>AsH3>PH3,故答案为:NH3>AsH3>PH3;
(4)EO2-为ClO2-,EO3-为ClO3-,它们的中心原子氯原子的价层电子对数均为
=4,所以氯原子都是sp3杂化,在ClO2-中有两个Cl-O键,所以ClO2-的空间构型为V形,而在ClO3-中有三个Cl-O键,所以ClO3-的空间构型为三角锥形;HClO2和HClO3可表示为(HO)ClO和(HO)ClO2,HClO2中的Cl为+3价,而HClO3中的Cl为+5价.HClO3中的Cl正电性更高,导致Cl-O-H中的电子更向Cl偏移,更易电离出H+,故HClO3的酸性更强,
故答案为:V形;三角锥形; HClO2和HClO3可表示为(OH)ClO和(OH)ClO2,HClO2中的Cl为+3价,而HClO3中的Cl为+5价,HClO3中的Cl正电性更高,导致Cl-O-H中的电子更向Cl偏移,更易电离出H+,故HClO3的酸性更强;
(5)B2H4为N2H4,
A.N2H4分子间与NH3相似,可形成氢键,故A正确;
B.N2H4分子中N原子的价层电子对数为
=4,所以氮原子是sp3杂化,故B正确;
C.N2H4分子中N原子之间是单键,所以没有π键,故C错误;
D.N2H4是分子晶体,所以晶体变为液态时破坏的是分子间作用力和氢键,故D错误;
故选AB;
(6)F是铁元素,铁是金属晶体,由金属阳离子和自由电子组成,自由电子在外加电场的作用下可发生定向移动,因此铁能导电;δ晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于晶胞的体心,补全晶胞可知配位数为8,γ晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于面心上,补全晶胞可知,有3层,每层有4个,故Fe原子的配位数为4×3=12.α晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于所在棱的顶点上,补全晶胞可知配位数为6,所以δ、γ、α三种晶胞中Fe原子的配位数之比为4:6:3;设铁原子的直径为a,根据晶胞结构图可知,δ晶胞的边长为
、γ晶胞的边长为
、α晶胞的边长为a,所以δ、γ、α三种晶胞的边长之比为
:
:a=
:
:1,
故答案为:铁是金属晶体,由金属阳离子和自由电子组成,自由电子在外加电场的作用下可发生定向移动,因此铁能导电;4:6:3;
:
:1.
(1)D是砷元素,原子序数为33,其基态原子的电子排布式为1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3,故答案为:1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3;
(2)A、C、X分别为Si、S、P,根据元素周期律,同周期元素从左向右,第一电离逐渐增大,但第ⅡA族和第ⅤA族由于最外层处于全满和半满状态,第一电离能高于相邻族的元素,所以Si、S、P的第一电离能大小顺序为P>S>Si,故答案为:P>S>Si;
(3)B、X、D氢化物分别为NH3、PH3、AsH3,因为氨分子之间有氢键的存在,所以氨的沸点较大,则AsH3>的相对分子质量大于PH3,所以沸点也高于PH3,所以它们的沸点由高到低的顺序为NH3>AsH3>PH3,故答案为:NH3>AsH3>PH3;
(4)EO2-为ClO2-,EO3-为ClO3-,它们的中心原子氯原子的价层电子对数均为
| 7+1 |
| 2 |
故答案为:V形;三角锥形; HClO2和HClO3可表示为(OH)ClO和(OH)ClO2,HClO2中的Cl为+3价,而HClO3中的Cl为+5价,HClO3中的Cl正电性更高,导致Cl-O-H中的电子更向Cl偏移,更易电离出H+,故HClO3的酸性更强;
(5)B2H4为N2H4,
A.N2H4分子间与NH3相似,可形成氢键,故A正确;
B.N2H4分子中N原子的价层电子对数为
| 5+1+1+1 |
| 2 |
C.N2H4分子中N原子之间是单键,所以没有π键,故C错误;
D.N2H4是分子晶体,所以晶体变为液态时破坏的是分子间作用力和氢键,故D错误;
故选AB;
(6)F是铁元素,铁是金属晶体,由金属阳离子和自由电子组成,自由电子在外加电场的作用下可发生定向移动,因此铁能导电;δ晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于晶胞的体心,补全晶胞可知配位数为8,γ晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于面心上,补全晶胞可知,有3层,每层有4个,故Fe原子的配位数为4×3=12.α晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于所在棱的顶点上,补全晶胞可知配位数为6,所以δ、γ、α三种晶胞中Fe原子的配位数之比为4:6:3;设铁原子的直径为a,根据晶胞结构图可知,δ晶胞的边长为
| 2a | ||
|
| 2a | ||
|
| 2a | ||
|
| 2a | ||
|
| 2 | ||
|
| 2 |
故答案为:铁是金属晶体,由金属阳离子和自由电子组成,自由电子在外加电场的作用下可发生定向移动,因此铁能导电;4:6:3;
| 2 | ||
|
| 2 |
点评:本题主要考查了原子核外电子排布、第一电离能、分子的结构与性质、原子杂化轨道、晶胞结构的计算等知识点,中等难度,解题时请注意基础知识的综合应用.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
某无色溶液中加入过量盐酸有沉淀产生,过滤后向滤液中加入过量氨水又有沉淀产生,下列溶液中符合条件的是( )
| A、Ag+、Al3+、Fe3+ |
| B、SiO32-、[Al(OH)4]-、K+ |
| C、Ag+、Cu2+、Na+ |
| D、Ag+、Ba2+、Na+ |
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢或锂电池的十倍,可连续使用一个月才充一次电,其电池反应为:2CH3OH+3O2H-=2CO32-+6H2O,则下列有关说法不正确的是( )
| A、放电时化学能转变为电能 |
| B、放电时CH3OH参与正极反应 |
| C、充电时阴极产CH3OH |
| D、充电时每生成1molCH3OH,则转移6mol电子 |
实验室制Cl2反应为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,则下列说法不正确的是( )
| ||
| A、还原剂是HCl,氧化剂是MnO2 |
| B、Cl2既是氧化产物又是还原产物 |
| C、每生成1molCl2转移电子的物质的量为2mol |
| D、每生成1molCl2有2molHCl被氧化 |
为了使Na2S溶液中
的比值变小,可适量加入(或通入)的物质是( )
| c(Na+) |
| c(S2-) |
| A、H2S气体 |
| B、NaOH固体 |
| C、HCl气体 |
| D、KOH固体 |
某8%的 NaOH溶液,其密度为1.15g/ml,则该NaOH溶液的物质的量浓度为( )
| A、1.15 mol/L |
| B、8.0 mol/L |
| C、4.6 mol/L |
| D、2.3mol/L |
在0.5L某浓度的Na2SO4溶液中含有0.5molNa+,下列对该溶液的说法中不正确的是( )
| A、该溶液的物质的量浓度为1mol/L |
| B、该溶液中含有35.5g Na2SO4 |
| C、配制1 00ml该溶液需用7.1g Na2SO4 |
| D、量取100ml该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1mol |
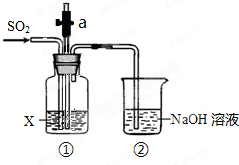 某同学用如图所示装置探究SO2的性质.
某同学用如图所示装置探究SO2的性质.