题目内容
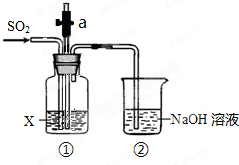 某同学用如图所示装置探究SO2的性质.
某同学用如图所示装置探究SO2的性质.请回答:
(1)装置②中发生反应的离子方程式是
(2)若X为品红溶液,可观察到装置①中溶液褪色,说明SO2具有
(3)若X为紫色石蕊溶液,可观察到装置①中溶液变红,说明SO2的水溶液显
a.酸性 b.碱性
(4)若X为
考点:二氧化硫的化学性质
专题:
分析:(1)二氧化硫通入到氢氧化钠溶液中先生成亚硫酸钠和水;
(2)SO2具有漂白性能使品红溶液退色;
(3)能使紫色石蕊溶液变红的是显酸性;
(4)根据该溶液不能与二氧化硫反应,但可以与硫酸根形成沉淀分析;
(2)SO2具有漂白性能使品红溶液退色;
(3)能使紫色石蕊溶液变红的是显酸性;
(4)根据该溶液不能与二氧化硫反应,但可以与硫酸根形成沉淀分析;
解答:
解:(1)二氧化硫通入到氢氧化钠溶液中先生成亚硫酸钠和水,所以离子方程式为:SO2+2OH-═SO32-+H2O,故答案为:SO2+2OH-═SO32-+H2O;
(2)SO2具有漂白性能使品红溶液退色,故答案为:漂白;
(3)能使紫色石蕊溶液变红的是显酸性,故答案为:a;
(4)根据题意,该溶液不能与二氧化硫反应,但可以与硫酸根形成沉淀,所以应该是强酸的可溶性钡盐,故答案为:BaCl2;
(2)SO2具有漂白性能使品红溶液退色,故答案为:漂白;
(3)能使紫色石蕊溶液变红的是显酸性,故答案为:a;
(4)根据题意,该溶液不能与二氧化硫反应,但可以与硫酸根形成沉淀,所以应该是强酸的可溶性钡盐,故答案为:BaCl2;
点评:本题主要考查了二氧化硫的酸性以及二氧化硫漂白性,解题时需从漂白原理分析才能正确解题,题目难度中等.

练习册系列答案
相关题目
室温下,等体积的、pH=2的 HCl和CH3COOH溶液,以下说法正确的是( )
| A、两溶液中由水电离的c(H+)前者小于后者 |
| B、两溶液分别和足量的锌反应,生成氢气的体积相等 |
| C、两溶液分别和相同的锌反应,生成氢气的起始速率相等 |
| D、两溶液分别和与其体积相等的、pH=12的NaOH溶液混合后,都呈中性 |
常温下,在溶液中可发生以下反应:①H++Z-+XO42-→X2++Z2+H2O(未配平),②2M2++R2═2M3++2R- ③2R-+Z2═R2+2Z-.由此判断下列说法正确的是( )
| A、氧化性强弱顺序为XO42->Z2>R2>M3+ |
| B、还原性强弱顺序为X2+>Z->R->M2+ |
| C、R元素在反应②中被氧化,在③中被还原 |
| D、常温下反应2M2++Z2═2M3++2Z-不可进行 |
溶液、胶体和浊液这三种分散系的根本区别是( )
| A、是否为大量分子或离子的集合体 |
| B、分散质微粒的大小不同 |
| C、能否通过滤纸或半透膜 |
| D、是否均一、稳定、透明 |
