题目内容
为了使Na2S溶液中
的比值变小,可适量加入(或通入)的物质是( )
| c(Na+) |
| c(S2-) |
| A、H2S气体 |
| B、NaOH固体 |
| C、HCl气体 |
| D、KOH固体 |
考点:影响盐类水解程度的主要因素
专题:
分析:在硫化钠溶液中电离出钠离子和硫离子,硫离子水解,导致硫离子浓度会减小,要使
的比值变小,根据硫离子水解平衡移动来分析.
| c(Na+) |
| c(S2-) |
解答:
解:在硫化钠溶液中电离出钠离子和硫离子,硫离子水解方程式为:S2-+H2O?HS-+OH-,
A、H2S气体,H2S与H2S反应生成NaHS,S2-浓度减小,使得比值变大,故A错误;
B、入氢氧化钠固体,会使的钠离子浓度增大,所以使得比值变大,故B错误;
C、加入HCl气体,平衡正向移动,使得硫离子浓度减小,所以比值变大,故C错误;
D、入加KOH固体,氢氧根离子浓度增大,硫离子水解平衡逆移,硫离子浓度增大,所以使得比值变小,故D正确;
故选D.
A、H2S气体,H2S与H2S反应生成NaHS,S2-浓度减小,使得比值变大,故A错误;
B、入氢氧化钠固体,会使的钠离子浓度增大,所以使得比值变大,故B错误;
C、加入HCl气体,平衡正向移动,使得硫离子浓度减小,所以比值变大,故C错误;
D、入加KOH固体,氢氧根离子浓度增大,硫离子水解平衡逆移,硫离子浓度增大,所以使得比值变小,故D正确;
故选D.
点评:本题考查学生盐的水解平衡移动,注意影响化学平衡的因素以及化学平衡移动的方向之间的关系,难度不大.

练习册系列答案
相关题目
下列有关说法正确的是( )
| A、反应2H2O═2H2+O2在任何条件下都不会自发进行 | ||
B、溶液CH3COOH加水稀释后,溶液中
| ||
| C、温度升高,反应物的活化分子数增多,主要因素是分子的运动加快,反应速率加快 | ||
| D、Na2CO3液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |
下列离子方程式书写不正确的是( )
| A、往NaOH溶液中通入过量CO2:CO2+OH-=HCO3- |
| B、单质硅与烧碱溶液反应:Si+2OH-+H2O=SiO32-+2H2↑ |
| C、石英砂与烧碱反应制水玻璃:SiO2+2OH-=SiO32-+H2O |
| D、往水玻璃中通入二氧化碳:Na2SiO3+2H2O+CO2=H4SiO4↓+2Na++CO32- |
常温下,在溶液中可发生以下反应:①H++Z-+XO42-→X2++Z2+H2O(未配平),②2M2++R2═2M3++2R- ③2R-+Z2═R2+2Z-.由此判断下列说法正确的是( )
| A、氧化性强弱顺序为XO42->Z2>R2>M3+ |
| B、还原性强弱顺序为X2+>Z->R->M2+ |
| C、R元素在反应②中被氧化,在③中被还原 |
| D、常温下反应2M2++Z2═2M3++2Z-不可进行 |
在x R2++y H++O2=z R3++n H2O的离子反应中,化学计量系数z值为( )
| A、x | ||
| B、2 | ||
C、
| ||
| D、4 |
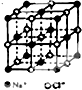 氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图所示.
氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图所示.