题目内容
17.为了探究铁和硫反应产物中铁的化合价为+2价或+3价或既有+2也有+3价,某同学设计了如下图所示的实验过程:(已知硫会溶于热碱溶液)
请回答以下问题:
(1)混合粉末A中S粉必须要过量,其原因是为了保证铁粉完全反应,从而避免过量的铁粉与操作③中的反应生成Fe2+而干扰实验验
(2)反应在“惰性气体环境中”进行的原因是防止Fe和S被氧化,尤其是Fe被氧化成Fe3O4而干扰实验
(3)操作①是用烧热的玻璃棒点触混合粉末,反应即可持续进行,这说明了硫和铁粉反应是放热反应
(4)操作②的作用是除去混合物中过量的硫粉.
(5)操作③中稀硫酸煮沸的目的是防止硫酸中溶解的O2将前面反应过程中可能生成的Fe2+氧化而干扰实验.
(6)为探究产物中铁的价态,需要继续对D溶液进行实验,请写出操作④的具体操作、现象及结论:取少量的D溶液于两支小试管中,向第一支试管中滴加少量KSCN溶液,向第二支试管中滴加少量酸性高锰酸钾溶液.如果第一支试管出现血红色,而第二支试管高锰酸钾紫红色不褪去,说明铁和硫反应只生成三价铁;如果第一支试管不变血红色,而第二支试管高锰酸钾紫红色褪去,说明只生成亚铁;如果第一支试管变血红色,第二支试管紫红色也褪去,说明既生成了三价铁也生成了亚铁.
分析 探究铁和硫反应产物实验流程:为防止Fe和S被氧气氧化,铁粉和硫粉在惰性气体环境中反应生成硫化亚铁,S粉必须要过量,保证铁粉完全反应,避免过量的铁粉与硫酸反应生成Fe2+而干扰实验,在黑色固体中加入热的氢氧化钾溶液,发生反应:3S+6KOH$\frac{\underline{\;\;△\;\;}}{\;}$2K2S+K2SO3+3H2O,除去混合物中过量的硫粉,将稀硫酸煮沸防止硫酸中溶解的O2将前面反应过程中可能生成的Fe2+氧化而干扰实验,取少量的D溶液于两支小试管中,向第一支试管中滴加少量KSCN溶液,向第二支试管中滴加少量酸性高锰酸钾溶液.
如果第一支试管出现血红色,而第二支试管高锰酸钾紫红色不褪去,说明铁和硫反应只生成三价铁;如果第一支试管不变血红色,而第二支试管高锰酸钾紫红色褪去,说明只生成亚铁;如果第一支试管变血红色,第二支试管紫红色也褪去,说明既生成了三价铁也生成了亚铁.
(1)混合粉末A中S粉必须要过量,保证铁粉完全反应,防止在操作③中过量的铁粉与硫酸反应生成+2价的铁干扰实验产物的检验;
(2)铁能和氧气反应生成四氧化三铁,硫和氧气反应生成二氧化硫,反应在“惰性气体环境中”进行防止Fe和S被氧化,尤其是Fe被氧化成Fe3O4而干扰实验;
(3)操作①是用烧热的玻璃棒点触,该发应能持续进行,说明该反应为放热反应;
(4)硫和热碱反应生成水和易溶于水的硫化钾和亚硫酸钾;
(5)氧气能氧化亚铁离子,操作③中稀硫酸煮沸的目的排除氧气的干扰;
(6)利用+3价的铁和硫氰根离子络合生成血红色的硫氰化铁检验+3价的铁,利用+2价的铁能使高锰酸根离子褪色检验+2价铁,据此设计实验.
解答 解:(1)实验目的:探究铁和硫反应产物中铁的化合价为+2价或+3价或既有+2也有+3价,铁粉和硫粉在惰性气体环境中反应生成硫化亚铁,如果铁粉过量,过量的铁粉与硫酸反应生成Fe2+而干扰实验产物的检验,所以混合粉末A中S粉必须要过量,
故答案为:过量的铁粉与操作③中的反应生成Fe2+而干扰实验验;
(2)四氧化三铁为黑色固体,铁能和氧气反应生成四氧化三铁,硫和氧气反应生成二氧化硫,混合粉末A中S粉反应在“惰性气体环境中”进行防止Fe和S被氧化,尤其是Fe被氧化成Fe3O4而干扰实验,
故答案为:防止Fe和S被氧化,尤其是Fe被氧化成Fe3O4而干扰实验;
(3)因硫和铁粉反应是放热反应,所以用烧热的玻璃棒点触,该发应能持续进行,
故答案为:硫和铁粉反应是放热反应;
(4)在黑色固体中加入热的氢氧化钾溶液,发生反应:3S+6KOH$\frac{\underline{\;\;△\;\;}}{\;}$2K2S+K2SO3+3H2O,除去混合物中过量的硫粉,
故答案为:除去混合物中过量的硫粉;
(5)操作③中稀硫酸煮沸,排出溶解在其中的氧气,防止硫酸中溶解的O2将前面反应过程中可能生成的Fe2+氧化而干扰实验,
故答案为:防止硫酸中溶解的O2将前面反应过程中可能生成的Fe2+氧化而干扰实验;
(6)+3价的铁和硫氰根离子络合生成血红色的硫氰化铁,+2价的铁能使高锰酸根离子褪色,取少量的D溶液于两支小试管中,向第一支试管中滴加少量KSCN溶液,向第二支试管中滴加少量酸性高锰酸钾溶液.如果第一支试管出现血红色,而第二支试管高锰酸钾紫红色不褪去,说明铁和硫反应只生成三价铁;如果第一支试管不变血红色,而第二支试管高锰酸钾紫红色褪去,说明只生成亚铁;如果第一支试管变血红色,第二支试管紫红色也褪去,说明既生成了三价铁也生成了亚铁,
故答案为:取少量的D溶液于两支小试管中,向第一支试管中滴加少量KSCN溶液,向第二支试管中滴加少量酸性高锰酸钾溶液.如果第一支试管出现血红色,而第二支试管高锰酸钾紫红色不褪去,说明铁和硫反应只生成三价铁;如果第一支试管不变血红色,而第二支试管高锰酸钾紫红色褪去,说明只生成亚铁;如果第一支试管变血红色,第二支试管紫红色也褪去,说明既生成了三价铁也生成了亚铁.
点评 本题考查了铁和硫反应产物的探究,侧重于离子的检验的考查,注意掌握铁、硫及其化合物的性质以及常见物质的检验方法,题目难度中等,侧重于考查学生的实验探究能力和对基础知识的综合应用能力.

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案| B | ||
| F |
(2)D和F的氢化物中沸点较高的是H2O(填化学式).
(3)实验室制取G2气体的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(4)在微电子工业中,C的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3•H2O+3H2O2=N2↑+8H2O.
(5)FD2气体通入BaCl2和C的最高价氧化物对应的水化物的混合溶液中,生成白色沉淀和无色气体,有关反应的离子方程式为3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO↑+4H+.
(6)火箭使用B2A8C2作燃料,N2O4为氧化剂,燃烧放出的巨大能量能把火箭送入太空,并且产生三种无污染的气体,其化学方程式为C2H8N2+2N2O4=2CO2+3N2+4H2O.
(7)上述元素可组成盐Q:CA4E(FD4)2.向盛有20mL0.5mol/LQ溶液的烧杯中加入12mL2.0mol/LBa(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为0.022mol.
| A. | 吸热反应一定是反应物总能量大于生成物的总能量 | |
| B. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| C. | 强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱 | |
| D. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
| A. | 氢氧化铁胶体在直流电场中,一段时间阴极附近红褐色加深,说明胶体带正电 | |
| B. | 一束可见光透过胶体时,有丁达尔效应产生 | |
| C. | 胶体属于混合物 | |
| D. | 氢氧化铁胶体能吸附水中的悬浮颗粒并沉淀,因此常用于净水 |
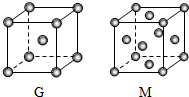 A、B、D、E、G、M六种元素位于元素周期表前四周期,原子序数依次增大.其中,元素A的一种核素无中子,B的单质既有分子晶体又有原子晶体,化合物DE2为红棕色气体,G是前四周期中电负性最小的元素,M的原子核外电子数比G多10.
A、B、D、E、G、M六种元素位于元素周期表前四周期,原子序数依次增大.其中,元素A的一种核素无中子,B的单质既有分子晶体又有原子晶体,化合物DE2为红棕色气体,G是前四周期中电负性最小的元素,M的原子核外电子数比G多10.