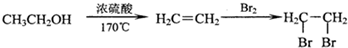题目内容
14.(1)铜、锌、稀硫酸构成原电池,负极为:锌,正极反应式:2H++2e-=H2↑.(2)以石墨为电极,电解KI溶液(其中含有少量酚酞和淀粉).阴极附近溶液呈红色,阳极附近溶液呈蓝色.
(3)锂锰电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图1所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2. 回答下列问题:
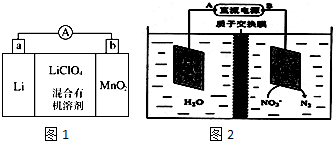
①外电路的电流方向是由b极流向a极.(填字母)
②电池正极反应式为MnO2+e-+Li+═LiMnO2.
(4)化学在环境保护中起着十分重要的作用,电化学降解法可用于治理酸性水中的硝酸盐污染.电化学降解NO3-的原理如图2所示.直流电源正极为A(填A或B),阴极反应式为2NO3-+10e-+12H+=6H2O+N2↑.
分析 (1)铜、锌、稀硫酸构成原电池中,Zn失电子作负极,Cu为正极,氢离子在正极上得电子生成氢气;
(2)以石墨为电极,电解KI溶液时,在阴极上是氢离子得电子,阳极上是碘离子失电子;
(3)形成原电池反应时,Li失电子为负极,MnO2为正极,外电路中电子从负极流向正极,电流与电子流向相反;
(4)硝酸根离子得电子生成氮气,则B相连的电极为阴极,所以B为负极,A为正极.
解答 解:(1)铜、锌、稀硫酸构成原电池中,Zn失电子作负极,Cu为正极,氢离子在正极上得电子生成氢气,则正极的电极反应为:2H++2e-=H2↑;
故答案为:锌;2H++2e-=H2↑;
(2)以石墨为电极,电解KI溶液时,在阴极上是氢离子得电子生成氢气,还生成氢氧根离子,加酚酞时,阴极附近变红色,阳极上是碘离子失电子生成碘单质,碘单质遇到淀粉会变蓝色;
故答案为:红;蓝;
(3)①形成原电池反应时,Li失电子为负极,即a 为负极,MnO2为正极,即b为正极,外电路中电子从负极流向正极,即电子从a流向b,则电流从b流向a,
故答案为:b;a;
②正极上MnO2被还原生成LiMnO2,则正极的电极方程式为:MnO2+e-+Li+=LiMnO2,
故答案为:MnO2+e-+Li+=LiMnO2;
(4)硝酸根离子得电子生成氮气,则B相连的电极为阴极,所以B为负极,A为正极,阴极上的反应为:2NO3-+10e-+12H+=6H2O+N2↑;
故答案为:A;2NO3-+10e-+12H+=6H2O+N2↑.
点评 本题侧重于电化学知识的全面考查,题目难度适中,能很好地考查学生的分析能力以及电化学知识的综合理解和运用,明确电解时离子的放电顺序及发生的电极反应是解答本题的关键.

练习册系列答案
相关题目
2.关于下列各装置图的叙述中,不正确的是( )
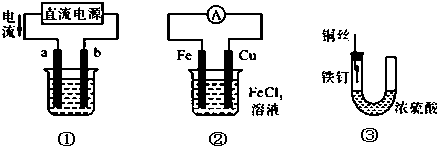

| A. | 用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 | |
| B. | 用装置①进行电镀,镀件接在b极上 | |
| C. | 装置②的总反应是:Cu+Fe3+═Cu2++Fe | |
| D. | 装置③中的铁钉几乎没被腐蚀 |
19.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H-1O$?_{充电}^{放电}$ 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
| A. | 放电时每转移3mol电子,正极有1mol K2FeO4被氧化 | |
| B. | 充电时阳极反应为:Fe(OH)3-3e-+5 OH-═FeO${\;}_{4}^{2-}$+4H2O | |
| C. | 放电时正极附近溶液的碱性增强 | |
| D. | 放电时负极反应为:Zn-2e-+2OH-═Zn(OH)2 |
6.使用容量瓶配制溶液,下列操作不正确的是( )
| A. | 使用容量瓶前检查它是否漏水 | |
| B. | 容量瓶用蒸馏水洗净后,再用待配溶液润洗 | |
| C. | 盖好瓶塞,用食指顶住瓶塞,用另一只手指托住瓶底,把容量瓶倒转和摇动几次 | |
| D. | 容量瓶不能长期存放配制好的溶液 |
3.当光束通过下列分散系时,可观察到丁达尔效应的是( )
| A. | 乙醇溶液 | B. | 氨化钠溶液 | C. | 盐酸 | D. | 氢氧化铁胶体 |

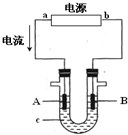 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题: .
. +2H2O;
+2H2O;