题目内容
3.当光束通过下列分散系时,可观察到丁达尔效应的是( )| A. | 乙醇溶液 | B. | 氨化钠溶液 | C. | 盐酸 | D. | 氢氧化铁胶体 |
分析 依据分散系的分类和性质分析,胶体分散系具有丁达尔现象,只要判断出分散系是胶体即可.
解答 解:乙醇溶液、氨化钠溶液、盐酸属于溶液分散系无丁达尔效应;氢氧化铁胶体分散质大小:1nm~100nm,属于胶体,有丁达尔效应.
故选D.
点评 本题考查胶体的性质,注意胶体的本质特征是:胶体粒子的微粒直径在1-100nm之间,这也是胶体与其它分散系的本质区别.区分胶体和溶液最简单的方法是利用丁达尔现象,难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
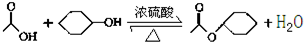
11.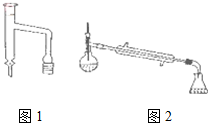 乙酸环己酯具有香蕉及苹果气味,主要用于配制各种饮料、冰淇淋等,实验室制备乙酸环己酯的反应原理、装置示意图和有关数据如下:
乙酸环己酯具有香蕉及苹果气味,主要用于配制各种饮料、冰淇淋等,实验室制备乙酸环己酯的反应原理、装置示意图和有关数据如下:
实验步骤:
将12.0g(0.2mol)乙酸、l0.0g(0.1mol)环己醇和15mL环己烷加入装有温度计、恒压滴液漏斗和球形冷凝管的四颈烧瓶中,在搅拌下,慢慢滴加15mL 98%浓硫酸,滴加完后将恒压滴液漏斗换成分水器装置,加热回流90min后,向反应液中依次加入水、10%的NaHCO3溶液、水洗涤,然后加无水MgSO4,放置过夜,加热蒸馏,收集168-174℃的馏分,得到无色透明、有香味的液体产品6.9g
(1)上述反应装置图中存在的一处错误是冷凝水应从下口进上口出.
(2)实验中控制乙酸的物质的量是环己醇的2倍,其目的是提高环已醇的转化率.
(3)分水器(图1)的作用是将生成的水及时从体系中分离出来,提高反应物的转化率.
(4)用l0%的NaHCO3溶液洗涤的目的是洗去硫酸和醋酸;第二次水洗的目的是洗去碳酸氢钠;加入无水MgSO4的目的是干燥.
(5)本次实验的产率为48.6%.(保留3位有效数字)
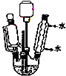
(6)若在进行蒸馏操作时,采用图2装置,会使实验的产率偏高
(填“偏高”或“偏低”),其原因是产品中会收集到未反应的环己醇.
 乙酸环己酯具有香蕉及苹果气味,主要用于配制各种饮料、冰淇淋等,实验室制备乙酸环己酯的反应原理、装置示意图和有关数据如下:
乙酸环己酯具有香蕉及苹果气味,主要用于配制各种饮料、冰淇淋等,实验室制备乙酸环己酯的反应原理、装置示意图和有关数据如下:
 | 相对分子质量 | 密度/g•cm-3 | 沸点 | 水中溶解性 | |
| 乙酸 | 60 | 1.051 | 118.0 | 溶 | |
| 环己醇 | 100 | 0.962 | 160.8 | 微溶 | |
| 乙酸环己酯 | 142 | 0.969 | 173.5 | 难溶 |
将12.0g(0.2mol)乙酸、l0.0g(0.1mol)环己醇和15mL环己烷加入装有温度计、恒压滴液漏斗和球形冷凝管的四颈烧瓶中,在搅拌下,慢慢滴加15mL 98%浓硫酸,滴加完后将恒压滴液漏斗换成分水器装置,加热回流90min后,向反应液中依次加入水、10%的NaHCO3溶液、水洗涤,然后加无水MgSO4,放置过夜,加热蒸馏,收集168-174℃的馏分,得到无色透明、有香味的液体产品6.9g
(1)上述反应装置图中存在的一处错误是冷凝水应从下口进上口出.
(2)实验中控制乙酸的物质的量是环己醇的2倍,其目的是提高环已醇的转化率.
(3)分水器(图1)的作用是将生成的水及时从体系中分离出来,提高反应物的转化率.
(4)用l0%的NaHCO3溶液洗涤的目的是洗去硫酸和醋酸;第二次水洗的目的是洗去碳酸氢钠;加入无水MgSO4的目的是干燥.
(5)本次实验的产率为48.6%.(保留3位有效数字)
(6)若在进行蒸馏操作时,采用图2装置,会使实验的产率偏高
(填“偏高”或“偏低”),其原因是产品中会收集到未反应的环己醇.
18.下列物质属于纯净物的是( )
| A. | 水泥 | B. | 不锈钢 | C. | 普 通玻璃 | D. | 液氯 |
8.下列叙述正确的是( )
| A. | 钠能与硫酸铜稀溶液反应,置换出红色的铜 | |
| B. | 为了消除碘缺乏病,在食用盐中必须加入一定量的单质碘 | |
| C. | 过氧化钠是淡黄色固体,可用作呼吸面具的供氧剂 | |
| D. | 氢气在氧气或氯气中燃烧,都能观察到淡蓝色火焰 |
15.有A、B、C、D四种强电解质,它们在水中电离产生系列离子(每种物质只含一种阴离子且互不重复).
已知:①A、C溶液的pH均大于7;
②一定浓度的A、B的溶液中水的电离程度可以相同;
③C溶液和D溶液相遇时只生成白色沉淀;
④仅B溶液和C溶液相遇时只生成刺激性气味的气体;
⑤A溶液和D溶液混合时无现象.
(1)写出A物质中所含化学键的类型离子键、共价键(或离子键、极性键和非极性键).
(2)写出C和D反应的离子方程式Ba2++SO42-=BaSO4↓.
(3)25℃时,0.1mol•L-1B溶液的pH=a,则B溶液中c(H+)-c(NH3•H20)=10 a-14(用含有a的关系式表示).
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+).
(5)25℃时,在一定体积的0.01mol•L-1的C溶液中,加入一定体积的0.01mol•L-1的盐酸,混合溶液的pH=12,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是2:1.
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
②一定浓度的A、B的溶液中水的电离程度可以相同;
③C溶液和D溶液相遇时只生成白色沉淀;
④仅B溶液和C溶液相遇时只生成刺激性气味的气体;
⑤A溶液和D溶液混合时无现象.
(1)写出A物质中所含化学键的类型离子键、共价键(或离子键、极性键和非极性键).
(2)写出C和D反应的离子方程式Ba2++SO42-=BaSO4↓.
(3)25℃时,0.1mol•L-1B溶液的pH=a,则B溶液中c(H+)-c(NH3•H20)=10 a-14(用含有a的关系式表示).
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+).
(5)25℃时,在一定体积的0.01mol•L-1的C溶液中,加入一定体积的0.01mol•L-1的盐酸,混合溶液的pH=12,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是2:1.
12.下列说法正确的是( )
| A. | 分子式为C3H6O的有机化合物性质相同 | |
| B. | 现在“点石成金”术石墨变成金刚石属于物理变化 | |
| C. | 过氧化钠与水反应成1mol氧气转移4mol电子 | |
| D. | 工业上冶炼铝时加入冰晶石的作用是降低氧化铝的熔融温度 |
13.某含Na+的溶液中还可能含有NH4+、Fe3+、Mg2+、Br-、CO32-、SO32-.取样,滴加足量氯水有气泡产生,溶液呈橙色;向橙色溶液中加BaCl2溶液无现象.为确定该溶液的组成,还需进行的实验有( )
| A. | 取样,加氯水和CCl4,振荡、静置 | |
| B. | 取样,加足量的NaOH浓溶液,加热,用湿润的红色石蕊试纸检验气体 | |
| C. | 取样,加足量盐酸加热,用湿润的品红试纸检验气体 | |
| D. | 取样,滴加硫氰化钾溶液 |
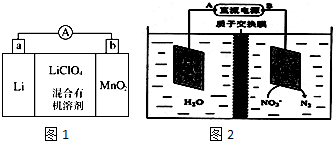
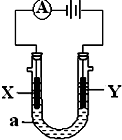 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: