题目内容
 在
在| T | 1 |
(1)该反应在0-10min时间内H2的平均反应速率为
(2)在
| T | 1 |
a 大于25% b 等于25% c 小于25%
(3)如图是在
| T | 1 |
| T | 2 |
(4)若保持
| T | 1 |
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)令平衡时参加反应氮气的物质的量为xmol,利用三段式表示出平衡时各组分的物质的量,根据氨气的体积分数列方程计算,再根据v=
计算v(H2),根据转化率等于计算氮气的转化率;
(2)起始时在容器甲中加入0.5molN2、1.5molH2、0.5molN H3,等效为开始加入0.75molN2、2.25molH2,进一步等效为在原平衡基础上降低压强,与原平衡相比平衡向逆反应方向移动,据此判断;
(3)温度T2>T1,升高温度反应速率加快,缩短到达平衡的时间,该反应为放热反应,平衡向逆反应方向移动,氢气的体积分数增大,据此作图;
(4)若保持
℃,在体积也为2L的密闭容器乙中通入一定量的N2、H2、NH3,欲使平衡时容器乙中各物质的量与容器甲中完全相同,则与甲为完全等效平衡,按化学计量数转化到左边满足氮气为1mol、氢气为3mol,且起始时反应向正反应方向进行,则通入氢气的物质的量应大于甲中的平衡时氢气的物质的量,由于氨气存在,故氢气应小于3mol.
| ||
| △t |
(2)起始时在容器甲中加入0.5molN2、1.5molH2、0.5molN H3,等效为开始加入0.75molN2、2.25molH2,进一步等效为在原平衡基础上降低压强,与原平衡相比平衡向逆反应方向移动,据此判断;
(3)温度T2>T1,升高温度反应速率加快,缩短到达平衡的时间,该反应为放热反应,平衡向逆反应方向移动,氢气的体积分数增大,据此作图;
(4)若保持
| T | 1 |
解答:
解:(1)令平衡时参加反应氮气的物质的量为xmol,则:
N2(g)+3H2(g)?2N H3(g)
开始(mol):1 3 0
变化(mol):x 3x 2x
平衡(mol):1-x 3-3x 2x
所以
=25%,解得x=0.4,
故v(H2)=
=0.06mol/(L.min),
氮气的转化率=
×100%=40%,
故答案为:0.06mol/(L.min);40%;
(2)起始时在容器甲中加入0.5molN2、1.5molH2、0.5molN H3,等效为开始加入0.75molN2、2.25molH2,进一步等效为在原平衡基础上降低压强,与原平衡相比平衡向逆反应方向移动,平衡时NH3的体积分数小于25%,
故答案为:c;
(3)升高温度反应速率加快,缩短到达平衡的时间,该反应为放热反应,平衡向逆反应方向移动,氢气的体积分数增大,温度T2>T1,故T2温度到达平衡时间较短、氢气的体积分数较大,图象为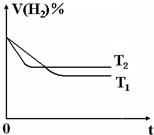 ,故答案为:
,故答案为: ;
;
(4)若保持
℃,在体积也为2L的密闭容器乙中通入一定量的N2、H2、NH3,欲使平衡时容器乙中各物质的量与容器甲中完全相同,则与甲为完全等效平衡,按化学计量数转化到左边满足氮气为1mol、氢气为3mol,且起始时反应向正反应方向进行,则通入氢气的物质的量应大于甲中的平衡时氢气的物质的量,由于氨气存在,故氢气应小于3mol,由(1)计算可知平衡时甲中氢气为3mol-3×0.4mol=1.8mol,故1.8mol<x<3mol,
故答案为:1.8mol<x<3mol.
N2(g)+3H2(g)?2N H3(g)
开始(mol):1 3 0
变化(mol):x 3x 2x
平衡(mol):1-x 3-3x 2x
所以
| 2x |
| 1-x+3-3x+2x |
故v(H2)=
| ||
| 10min |
氮气的转化率=
| 0.4mol |
| 1mol |
故答案为:0.06mol/(L.min);40%;
(2)起始时在容器甲中加入0.5molN2、1.5molH2、0.5molN H3,等效为开始加入0.75molN2、2.25molH2,进一步等效为在原平衡基础上降低压强,与原平衡相比平衡向逆反应方向移动,平衡时NH3的体积分数小于25%,
故答案为:c;
(3)升高温度反应速率加快,缩短到达平衡的时间,该反应为放热反应,平衡向逆反应方向移动,氢气的体积分数增大,温度T2>T1,故T2温度到达平衡时间较短、氢气的体积分数较大,图象为
 ,故答案为:
,故答案为: ;
;(4)若保持
| T | 1 |
故答案为:1.8mol<x<3mol.
点评:本题考查化学平衡计算、化学反应速率计算、等效平衡等,难度中等,(2)(3)注意根据等效平衡进行解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列离子方程式正确的是( )
| A、过量SO2通入Ba(NO3)2溶液3SO2+2NO3-+3Ba2++2H2O═3BaSO4+2NO+4H+ | ||
| B、1mol的Cl2通入含1mol FeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | ||
C、甲醛溶液中加入足量的银氨溶液并加热:HCHO+2[Ag(NH3)2]++2OH-
| ||
| D、向硫酸铝铵矾溶液中滴加过量的氢氧化钡溶液:NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3?H2O+2H2O |
室温下,下列各组微粒在指定溶液中能大量共存的是( )
| A、pH=1的溶液中:CH3CH2OH、Cr2O72-、K+、SO42- |
| B、加入铝粉放出大量H2的溶液:Fe2+、Na+、Cl-、NO3- |
| C、NaHCO3溶液中:C6H5O-、CO32-、Br-、K+ |
| D、c(Ca2+)=0.1mol?L-1的溶液中:NH4+、SiO32-、CH3COO-、Br- |
假设与猜想是科学探究的先导,在下列假设(或猜想)引导下的探究活动肯定没有实际意义的是( )
| A、探究浓硫酸与铜在一定条件下反应产生的黑色物质中可能有CuS |
| B、探究SO2和Na2O2反应可能有Na2SO4生成 |
| C、探究Na与水的反应可能有O2生成 |
| D、向滴有酚酞的NaOH溶液中通入 Cl2,探究红色褪去的原因是溶液的酸碱性变化还是HClO的漂白性所致 |
设NA为阿伏加德罗常数的值,下列说法错误的是( )
| A、标准状况下,22.4 L乙烷分子含极性键数6NA |
| B、0.1 molNa与足量水反应生成H2 0.1NA |
| C、46gNO2气体中氧原子总数为2NA |
| D、15 g甲基(-CH3)所含的电子数为9NA |
1g O2含有m个氧分子,则阿伏伽德罗常数的数值可表示为( )
A、
| ||
B、
| ||
| C、32m | ||
| D、16m |
下列有关电解质溶液的叙述符合科学性的是( )
| A、将等物质的量浓度等体积的醋酸溶液和醋酸钠溶液混合后,混合液中:C(CH3COO-)+2C(OH-)=2C(H+)+C(CH3COOH) |
| B、将pH=a的醋酸溶液稀释l倍后,pH:b,则a一定大于b |
| C、在滴有酚酞试液的氨水中加入NH2C1固体至溶液恰好无色时,则溶液pH:7 |
| D、菜醋酸与醋酸钠的混合液pH=5.6,其中C(CH3COO-)<C(Na+) |
 元素及其化合物的知识是高中化学重要的组成部分,是考查化学基本概念和理论、化学计算、化学实验知识的载体.
元素及其化合物的知识是高中化学重要的组成部分,是考查化学基本概念和理论、化学计算、化学实验知识的载体.