题目内容
16.今有七种物质:①铝线 ②熔化的KNO3 ③氯气 ④NaCl 晶体⑤液态氯化氢 ⑥石灰水 ⑦乙醇(1)其中能导电的物质是①②⑥
(2)属于电解质的是②④⑤
(3)属于非电解质的是⑦.
分析 金属、石墨能导电,电解质在水溶液或熔化状态下能够导电;
电解质在水溶液或熔化状态下能够导电的化合物;
非电解质是指在水溶液里和熔化状态下都不能导电的化合物.
解答 解:①铝线是金属单质,能导电,但是既不是电解质也不是非电解质;
②熔化的KNO3能导电,属于化合物,属于电解质;
③氯气不能导电,属于单质,既不是电解质也不是非电解质;
④NaCl晶体不能导电,溶于水或熔融状态下能导电,属于电解质;
⑤液态氯化氢不能导电,溶于水能导电,属于电解;
⑥石灰水能导电,属于混合物,既不是电解质也不是非电解质;
⑦乙醇不能导电,属于非电解质,故答案为:①②⑥;②④⑤;⑦.
点评 本题考查了电解质和非电解质的概念,以及电解质和金属导电的问题,属于易错题目,需要学习时认真归纳和总结,积累相关知识.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案
相关题目
6.下列离方方程式书写正确的是( )
| A. | 铁与醋酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 硫酸铜溶液与氢氢化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| C. | 铜与硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| D. | 碳酸氢钙与盐酸反应:HCO3-+H+═H2O+CO2↑ |
4.下列关于物质的分类中,均正确的是( )
| A. | Cu丝--电解质;KOH--电解质 | |
| B. | NaCl--电解质;葡萄糖(C6H12O6)--非电解质 | |
| C. | NaCl溶液--非电解质;酒精--非电解质 | |
| D. | O2--不属于电解质或非电解质;MgCl2--非电解质 |
11.室温时下列溶液中的粒子浓度关系正确的是( )
| A. | 相同物质的量浓度的溶液:①(NH4)2SO4 ②NH4HCO3 ③NH4Cl ④NH3•H2O中,c(NH4)由大到小的顺序是:①>③>②>④ | |
| B. | 将等体积的盐酸和氨水混合后pH=7:c(NH4+)>c(Cl-) | |
| C. | 0.1 mol•L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) | |
| D. | 向硝酸钠溶液中滴加稀盐酸得到pH=5的混合溶液:c(Na+)=c(NO3-)+c(Cl-) |
1.反应A(g)+3B(g)═2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是( )
| A. | v(D)=6 mol•(L•min)-1 | B. | v(C)=0.5 mol•(L•s)-1 | ||
| C. | v(B)=0.6 mol•(L•s)-1 | D. | v(A)=0.15 mol•(L•s)-1 |
2.实验:①0.1mol•L-1AgNO3溶液和0.1mol•L-1NaCl溶液等体积混合得到浊液,过滤.
②分别取少量①的浊液,分别滴加等浓度等体积的饱和Na2S溶液、饱和Na2SO4溶液,前者出现浑浊,后者溶液仍澄清③取少量①的沉淀,滴加几滴氨水,沉淀逐渐溶解
下列分析不正确的是( )
②分别取少量①的浊液,分别滴加等浓度等体积的饱和Na2S溶液、饱和Na2SO4溶液,前者出现浑浊,后者溶液仍澄清③取少量①的沉淀,滴加几滴氨水,沉淀逐渐溶解
下列分析不正确的是( )
| A. | 实验②证明了①的滤液中含有Ag+,由此推断的滤液中也含有Cl- | |
| B. | 由实验③推测:若在①的沉淀中滴加NaOH溶液,沉淀也能溶解 | |
| C. | 实验的溶液中含有[Ag(NH3)2]+微粒 | |
| D. | 实验证明了该温度下Ag2S比Ag2SO4更难溶解 |
19.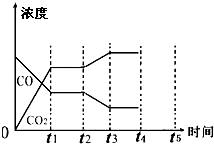 700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):
请回答下列问题:
(1)保持其他条件不变,若起始时向容器中充入0.60molCO和1.20molH2O,则平衡时n(CO2)=0.4molmol
(2)温度升至800℃,上述反应的平衡常数为0.64,则正反应是放热反应(填“放热”或“吸热”)
(3)700℃时,若向容积为2L的密闭容器中充入CO、H2O、CO2、H2的物质的量分别为1.20mol、2.00mol、1.20mol、1.20mol,则此时该反应的V正>V逆(填“>”、“<”或“=”)
(4)该反应在t1时刻建立平衡,在t2时刻因改变某个条件导致CO、CO2浓度发生变化的情况如图所示,则t2时刻改变的条件可能是降低温度、增加水蒸汽的量或减少氢气的量(写出两种)
(5)若该容器体积不变、绝热,则下列情况中说明反应建立平衡的是①④
①体系的压强不再发生变化
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④体系的温度不再发生变化.
 700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.20 | |
| t2 | 0.80 |
(1)保持其他条件不变,若起始时向容器中充入0.60molCO和1.20molH2O,则平衡时n(CO2)=0.4molmol
(2)温度升至800℃,上述反应的平衡常数为0.64,则正反应是放热反应(填“放热”或“吸热”)
(3)700℃时,若向容积为2L的密闭容器中充入CO、H2O、CO2、H2的物质的量分别为1.20mol、2.00mol、1.20mol、1.20mol,则此时该反应的V正>V逆(填“>”、“<”或“=”)
(4)该反应在t1时刻建立平衡,在t2时刻因改变某个条件导致CO、CO2浓度发生变化的情况如图所示,则t2时刻改变的条件可能是降低温度、增加水蒸汽的量或减少氢气的量(写出两种)
(5)若该容器体积不变、绝热,则下列情况中说明反应建立平衡的是①④
①体系的压强不再发生变化
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④体系的温度不再发生变化.
20.在相同的温度和压强下,4个相同体积的密闭容器中分 别装有4种气体.则4个容器中气体的质量最大是( )
| A. | CO2, | B. | O2 | C. | N2 | D. | CH4 |