题目内容
7.下列有关AgCl沉淀的溶解平衡的说法中,正确的是( )| A. | AgCl沉淀生成和溶解不断进行,但速率相等 | |
| B. | AgCl难溶于水,溶液中没有Ag+和Cl- | |
| C. | 其他条件不变时,加水可使Ksp(AgCl)增大 | |
| D. | 向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度不变 |
分析 溶解平衡为的动态平衡,AgCl饱和溶液中存在Ag+和Cl-,达到平衡时,正逆反应速率相等,改变离子浓度,可使平衡发生移动,注意溶度积只与温度有关,以此解答.
解答 解:A.达到沉淀溶解平衡时,AgCl沉淀生成和沉淀溶解不断进行,是动态平衡,速率相等但是不为零,故A正确;
B.AgCl难溶于水,溶解度很小,但是不为零,所以溶液中含有少量的Ag+和Cl-,故B错误;
C.Ksp只与温度有关,温度不变Ksp不变,不随浓度的改变而改变,故C错误;
D.加入NaCl固体,氯离子浓度增大,沉淀溶解平衡逆向进行,会析出AgCl固体,AgCl的溶解度减小,故D错误;
故选A.
点评 本题主要考查了沉淀溶解平衡及其影响因素,题目难度不大,明确溶解平衡的实质及其影响因素为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
4.下列关于物质的分类中,均正确的是( )
| A. | Cu丝--电解质;KOH--电解质 | |
| B. | NaCl--电解质;葡萄糖(C6H12O6)--非电解质 | |
| C. | NaCl溶液--非电解质;酒精--非电解质 | |
| D. | O2--不属于电解质或非电解质;MgCl2--非电解质 |
1.反应A(g)+3B(g)═2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是( )
| A. | v(D)=6 mol•(L•min)-1 | B. | v(C)=0.5 mol•(L•s)-1 | ||
| C. | v(B)=0.6 mol•(L•s)-1 | D. | v(A)=0.15 mol•(L•s)-1 |
2.实验:①0.1mol•L-1AgNO3溶液和0.1mol•L-1NaCl溶液等体积混合得到浊液,过滤.
②分别取少量①的浊液,分别滴加等浓度等体积的饱和Na2S溶液、饱和Na2SO4溶液,前者出现浑浊,后者溶液仍澄清③取少量①的沉淀,滴加几滴氨水,沉淀逐渐溶解
下列分析不正确的是( )
②分别取少量①的浊液,分别滴加等浓度等体积的饱和Na2S溶液、饱和Na2SO4溶液,前者出现浑浊,后者溶液仍澄清③取少量①的沉淀,滴加几滴氨水,沉淀逐渐溶解
下列分析不正确的是( )
| A. | 实验②证明了①的滤液中含有Ag+,由此推断的滤液中也含有Cl- | |
| B. | 由实验③推测:若在①的沉淀中滴加NaOH溶液,沉淀也能溶解 | |
| C. | 实验的溶液中含有[Ag(NH3)2]+微粒 | |
| D. | 实验证明了该温度下Ag2S比Ag2SO4更难溶解 |
12.已知AgCl和AgBr的溶解度分别为S(AgCl)=1×10-4、S(AgBr)=8.4×10-6,将AgCl与AgBr的饱和溶液等体积混合,再加入足量的浓硝酸银溶液,发生的反应为( )
| A. | 只有AgBr沉淀生成 | B. | AgCl和AgBr沉淀等量生成 | ||
| C. | AgCl沉淀少于AgBr沉淀 | D. | AgCl沉淀多于AgBr沉淀 |
19. 700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):
请回答下列问题:
(1)保持其他条件不变,若起始时向容器中充入0.60molCO和1.20molH2O,则平衡时n(CO2)=0.4molmol
(2)温度升至800℃,上述反应的平衡常数为0.64,则正反应是放热反应(填“放热”或“吸热”)
(3)700℃时,若向容积为2L的密闭容器中充入CO、H2O、CO2、H2的物质的量分别为1.20mol、2.00mol、1.20mol、1.20mol,则此时该反应的V正>V逆(填“>”、“<”或“=”)
(4)该反应在t1时刻建立平衡,在t2时刻因改变某个条件导致CO、CO2浓度发生变化的情况如图所示,则t2时刻改变的条件可能是降低温度、增加水蒸汽的量或减少氢气的量(写出两种)
(5)若该容器体积不变、绝热,则下列情况中说明反应建立平衡的是①④
①体系的压强不再发生变化
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④体系的温度不再发生变化.
 700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.20 | |
| t2 | 0.80 |
(1)保持其他条件不变,若起始时向容器中充入0.60molCO和1.20molH2O,则平衡时n(CO2)=0.4molmol
(2)温度升至800℃,上述反应的平衡常数为0.64,则正反应是放热反应(填“放热”或“吸热”)
(3)700℃时,若向容积为2L的密闭容器中充入CO、H2O、CO2、H2的物质的量分别为1.20mol、2.00mol、1.20mol、1.20mol,则此时该反应的V正>V逆(填“>”、“<”或“=”)
(4)该反应在t1时刻建立平衡,在t2时刻因改变某个条件导致CO、CO2浓度发生变化的情况如图所示,则t2时刻改变的条件可能是降低温度、增加水蒸汽的量或减少氢气的量(写出两种)
(5)若该容器体积不变、绝热,则下列情况中说明反应建立平衡的是①④
①体系的压强不再发生变化
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④体系的温度不再发生变化.
16.超音速飞机在平流层飞行时,尾气中的NO 会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO 和CO 转变成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO 和CO 浓度如下表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)写出该反应的平衡常数表达式K=$\frac{c({N}_{2})•c^2(C{O}_{2})}{c^2(NO)•c^2(CO)}$.
(2)前2s 内的平均反应速率v(CO2)=3.75×10-4mol/L•s.
(3)在上述条件下反应能够自发进行,则反应的△H<0(填写“>”、“<”、“=”).
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO 转化率的是CD.
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)在温度和体积保持不变的条件下,能够说明该反应达到平衡状态的标志是D.
A.反应混合物各组分物质的量浓度相等 B.NO、CO、CO2、N2分子数之比为2:2:2:1
C.混合气体的密度保持不变 D.单位时间内消耗1molNO 的同时,就有1molCO 生成.
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO 和CO 浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| -c(NO)/mol•L -1 | 1.00×10 -3 | 4.50×10-4 | 2.50×10 -4 | 1.50×10 -4 | 1.00×10 -4 | 1.00×10 -4 |
| -c(CO)/mol•L-1 | 3.60×10 -3 | 3.05×10 -3 | 2.85×10 -3 | 2.75×10 -3 | 2.70×10 -3 | 2.70×10-3 |
(1)写出该反应的平衡常数表达式K=$\frac{c({N}_{2})•c^2(C{O}_{2})}{c^2(NO)•c^2(CO)}$.
(2)前2s 内的平均反应速率v(CO2)=3.75×10-4mol/L•s.
(3)在上述条件下反应能够自发进行,则反应的△H<0(填写“>”、“<”、“=”).
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO 转化率的是CD.
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)在温度和体积保持不变的条件下,能够说明该反应达到平衡状态的标志是D.
A.反应混合物各组分物质的量浓度相等 B.NO、CO、CO2、N2分子数之比为2:2:2:1
C.混合气体的密度保持不变 D.单位时间内消耗1molNO 的同时,就有1molCO 生成.
17.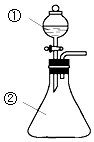 将①中液体逐滴滴入到②中(如图),实验结果与预测的现象一致的是( )
将①中液体逐滴滴入到②中(如图),实验结果与预测的现象一致的是( )
 将①中液体逐滴滴入到②中(如图),实验结果与预测的现象一致的是( )
将①中液体逐滴滴入到②中(如图),实验结果与预测的现象一致的是( )| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 氨水 | 氯化铝溶液 | 产生白色沉淀 |
| B | 浓硫酸 | 铜片 | 产生大量气体溶液变蓝 |
| C | 浓硝酸 | 用砂纸打磨过的铝条 | 产生大量红棕色气体 |
| D | 稀盐酸 | Na2CO3与NaOH的混合液 | 立即产生大量气体 |
| A. | A | B. | B | C. | C | D. | D |



