题目内容
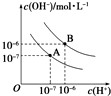 已知水在25℃(A)和T℃(B)时,其电离平衡曲线如图所示:
已知水在25℃(A)和T℃(B)时,其电离平衡曲线如图所示:(1)25℃时,将pH=3 的H2SO4溶液与pH=10的NaOH溶液混合,若所得混合溶液的pH=7,则H2SO4溶液与NaOH溶液的体积比为
(2)T℃时,若10体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是
(3)曲线B对应温度下,pH=3的HCl溶液和pH=9的某碱溶液等体积混合后,混合溶液的pH=7.请分析其原因:
考点:pH的简单计算
专题:
分析:(1)根据溶液的pH计算出溶液中氢离子、氢氧根离子浓度,再列式计算出氢氧化钠溶液和硫酸溶液的体积;
(2)酸、碱都是强电解质,溶液呈中性说明氢离子和氢氧根离子的物质的量相等;
(3)pH=3的盐酸溶液和pH=9的某碱溶液等体积混合后,氢离子和氢氧根离子恰好反应,根据盐的性质分析.
(2)酸、碱都是强电解质,溶液呈中性说明氢离子和氢氧根离子的物质的量相等;
(3)pH=3的盐酸溶液和pH=9的某碱溶液等体积混合后,氢离子和氢氧根离子恰好反应,根据盐的性质分析.
解答:
解:(1)25℃时,pH=3的H2SO4溶液中C(H+)=10-3 mol/L,pH=10的NaOH溶液中C(OH-)=10-4 mol/L,要使混合溶液呈中性,则氢氧根离子的物质的量等于氢离子的物质的量,设酸的体积为xL,碱的体积为yL,则10-3 mol/L×xL=10-4 mol/L×yL,
所以x:y=10-4:10-3=1:10,故答案为:1:10;
(2)T℃时,pH1=a的某强酸溶液中C(H+)=10-a mol/L,pH2=b的某强碱溶液C(OH-)=10b-12 mol/L,溶液呈中性,则酸中氢离子的物质的量应等于碱中氢氧根离子的物质的量,所以10×10-a=1×10b-12,a+b=13,故答案为:a+b=13;
(3)曲线B对应温度下,pH=3的盐酸溶液和pH=9的某碱溶液等体积混合后,氢离子和氢氧根离子恰好反应,如果碱是强碱,则盐溶液呈中性,实际上溶液呈碱性,则碱为弱碱,生成强酸弱碱盐水解呈碱性,中和后混合溶液中还剩余较多的弱碱分子,可继续电离出OH-,使溶液呈碱性,
故答案为:该碱为弱碱,中和后混合溶液中还剩余较多的弱碱分子,可继续电离出OH-,使溶液呈碱性.
所以x:y=10-4:10-3=1:10,故答案为:1:10;
(2)T℃时,pH1=a的某强酸溶液中C(H+)=10-a mol/L,pH2=b的某强碱溶液C(OH-)=10b-12 mol/L,溶液呈中性,则酸中氢离子的物质的量应等于碱中氢氧根离子的物质的量,所以10×10-a=1×10b-12,a+b=13,故答案为:a+b=13;
(3)曲线B对应温度下,pH=3的盐酸溶液和pH=9的某碱溶液等体积混合后,氢离子和氢氧根离子恰好反应,如果碱是强碱,则盐溶液呈中性,实际上溶液呈碱性,则碱为弱碱,生成强酸弱碱盐水解呈碱性,中和后混合溶液中还剩余较多的弱碱分子,可继续电离出OH-,使溶液呈碱性,
故答案为:该碱为弱碱,中和后混合溶液中还剩余较多的弱碱分子,可继续电离出OH-,使溶液呈碱性.
点评:本题考查了水的电离、水的离子积及溶液pH的简单计算,题目难度中等,解题关键是在搞清楚温度对水电离平衡、水的离子积和溶液pH的影响.

练习册系列答案
相关题目
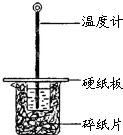 某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法不正确的是( )
某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法不正确的是( )| A、该实验也可在保温杯中进行 |
| B、图中实验装置缺少环形玻璃搅拌棒 |
| C、烧杯间填满碎纸条的作用是保温、隔热,减少热量损失 |
| D、若将盐酸体积改为60 mL,两次实验所求得中和热不相等 |
近来科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子作溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全.电池总反应式为C2H5OH+3O2═2CO2+3H2O,下列说法不正确的是( )
| A、C2H5OH在电池的负极上发生氧化反应 |
| B、1mol乙醇被氧化转移6 mol电子 |
| C、在外电路中电子由负极沿导线流向正极 |
| D、电池正极的电极反应为4H++O2+4e-═2H2O |
下列离子在溶液中能大量共存的是( )
| A、Na+、CO32-、SO42-、H+ |
| B、K+、OH-、H+、Cl- |
| C、Mg2+、H+、NO3-、SO42- |
| D、Fe3+、K+、OH-、NO3- |
下图所示四种化学实验操作的名称按①②③④顺序排列分别为( )


| A、过滤、蒸发、蒸馏、萃取(或分液或萃取分液) |
| B、过滤、蒸馏、蒸发、萃取 |
| C、蒸发、蒸馏、过滤、萃取 |
| D、萃取、蒸馏、蒸发、过滤 |
下列说法不正确的是( )
| A、浓硝酸保存在玻璃塞的棕色试剂瓶中 |
| B、已经完成定容的500mL 1.0mol?L-1 的NaOH溶液,某同学不慎将容量瓶中溶液洒出,只能重新配制 |
| C、导管口点燃CO时需要验纯,H2加热还原CuO时也需要验纯 |
| D、物质溶于水的过程中,一般有放热或吸热现象,因此溶解的操作不能在量筒中进行 |
下列说法正确的是( )
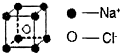

| A、1mol白磷晶体中含有的P-P键的个数为4NA |
| B、12g金刚石中含有的C-C键的个数为1.5NA |
| C、12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
| D、1mol氯化钠(晶胞如图)中含有Na+数目为8NA |
已知:H2(g)+F2(g)═2HF(g)△H=-270kJ?mol-1,下列说法正确的是( )
| A、2 L氟化氢气体分解成1 L氢气与1 L氟气吸收270 kJ热量 |
| B、1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ |
| C、在相同条件下,1 mol氢气与1 mol氟气的能量总和大于2 mol氟化氢气体的能量 |
| D、1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量 |