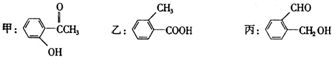
题目内容
18.离子检验(1)检验Na2SO3样品部分被氧化的实验操作及现象取少量固体溶于水,先足量加盐酸后,再加氯化钡,观察到生成白色沉淀,
(2)检验Na2SO4中含有少量NaCl的实验操作及现象取少量固体溶于水,先与足量硝酸钡反应后,过滤,向滤液中加硝酸银,观察到生成白色沉淀.
(3)NH4+的检验
试剂及用品:NaOH溶液、酒精灯、红色石蕊试纸;
操作及现象:在试管中取少量含铵根离子的溶液,滴加碱,并加热,在试管口用红色石蕊试纸检验气体,试纸变蓝.
分析 (1)若被氧化,混有硫酸钠,先加盐酸后,再加氯化钡可检验;
(2)检验Na2SO4中含有少量NaCl,先与足量硝酸钡反应后,再加硝酸银检验;
(3)铵根离子与碱反应生成氨气,检验氨气利用红色石蕊试纸.
解答 解:(1)检验Na2SO3样品部分被氧化的实验操作及现象为取少量固体溶于水,先足量加盐酸后,再加氯化钡,观察到生成白色沉淀,
故答案为:取少量固体溶于水,先足量加盐酸后,再加氯化钡,观察到生成白色沉淀;
(2)检验Na2SO4中含有少量NaCl,实验操作及现象为取少量固体溶于水,先与足量硝酸钡反应后,过滤,向滤液中加硝酸银,观察到生成白色沉淀,
故答案为:取少量固体溶于水,先与足量硝酸钡反应后,过滤,向滤液中加硝酸银,观察到生成白色沉淀;
(3)检验铵根离子需要的试剂为NaOH溶液、用品为酒精灯、红色石蕊试纸等,操作及现象为在试管中取少量含铵根离子的溶液,滴加碱,并加热,在试管口用红色石蕊试纸检验气体,试纸变蓝,
故答案为:NaOH溶液、酒精灯、红色石蕊试纸;在试管中取少量含铵根离子的溶液,滴加碱,并加热,在试管口用红色石蕊试纸检验气体,试纸变蓝.
点评 本题考查物质的检验和鉴别、离子的检验,为高频考点,把握物质的性质、发生的反应及检验方法为解答的关键,侧重分析与实验能力的考查,注意检验中排除干扰因素,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
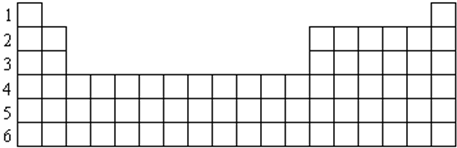
9.表是元素周期表一部分,列出了十个元素在周期表中的位置:
请用化学用语回答下列问题:
(1)在①~⑦元素中,原子半径最大的是K(填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式),⑤所对应元素的单质工业制备方法为2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
(3)用电子式表示元素③与⑧形成化合物的过程 .
.
(4)我国首创以单质⑤-空气-海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使单质⑤不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光.则电源的负极反应是4Al-12e-=4Al3+,正极反应为3O2+6H2O+12e-=12OH-.
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | |||||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑧ | ⑩ | ||
| 4 | ② | ④ | ⑨ |
(1)在①~⑦元素中,原子半径最大的是K(填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式),⑤所对应元素的单质工业制备方法为2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
(3)用电子式表示元素③与⑧形成化合物的过程
 .
.(4)我国首创以单质⑤-空气-海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使单质⑤不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光.则电源的负极反应是4Al-12e-=4Al3+,正极反应为3O2+6H2O+12e-=12OH-.
13.煤是工业的粮食,石油是工业的血液.下列关于煤和石油的说法中错误的是( )
| A. | 石油裂解主要目的是得到短链的不饱和烃 | |
| B. | 煤中含有苯和甲苯,可用先干馏后分馏的方法将它们分离出来 | |
| C. | 煤的气化与液化都是化学变化 | |
| D. | 含C18以上烷烃的重油经过催化裂化可以得到汽油 |
3.铁和足量稀H2SO4反应时,若铁失去0.2mol电子,则参加的铁的质量为( )
| A. | 2.8g | B. | 5.6g | C. | 8.4g | D. | 11.2g |
7.相对分子质量为100的饱和链状烷烃,同分异构体中主链有5个原子的有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
4.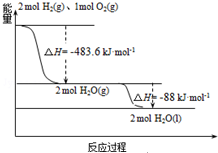 发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
(1)H2(g)═H2(l)△H1=-0.92kJ•mol-1
(2)O2(g)═O2(l)△H2=-6.84kJ•mol-1
下列说法正确的是( )
 发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:(1)H2(g)═H2(l)△H1=-0.92kJ•mol-1
(2)O2(g)═O2(l)△H2=-6.84kJ•mol-1
下列说法正确的是( )
| A. | H2(g)与O2(g)反应生成H2O(g)放热483.6kJ•mol-1 | |
| B. | 氢气的燃烧热为△H=-241.8 kJ•mol-1 | |
| C. | 火箭中液氢燃烧的热化学方程式为:2H2(l)+O2(l)═2H2O(g)△H=-474.92kJ•mol-1 | |
| D. | H2O(g)=H2O(l)△H=-88kJ•mol-1 |
 .
.