题目内容
4. 发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:(1)H2(g)═H2(l)△H1=-0.92kJ•mol-1
(2)O2(g)═O2(l)△H2=-6.84kJ•mol-1
下列说法正确的是( )
| A. | H2(g)与O2(g)反应生成H2O(g)放热483.6kJ•mol-1 | |
| B. | 氢气的燃烧热为△H=-241.8 kJ•mol-1 | |
| C. | 火箭中液氢燃烧的热化学方程式为:2H2(l)+O2(l)═2H2O(g)△H=-474.92kJ•mol-1 | |
| D. | H2O(g)=H2O(l)△H=-88kJ•mol-1 |
分析 A.由图象分析,2mol H2(g)与1mol O2(g)反应生成2mol H2O(g)放出483.6kJ的热量;
B.氢气的燃烧热是指1mol氢气完全燃烧生成液态水放出的热量;
C.由图象分析,2H2(g)+O2(g)═H2O(l)△H1=-483.6kJ•mol-1①,
H2(g)=H2(l)△H1=-0.92kJ•mol-1②
O2(g)=O2(l)△H2=-6.84kJ•mol-1③
将①-②×2-③×2利用盖斯定律计算;
D.根据图象可知,2molH2O(g)生成2molH2O(l)时放出88kJ热量.
解答 解:A.由图象分析,2mol H2(g)与1mol O2(g)反应生成2mol H2O(g),放出483.6kJ的热量,则H2(g)与O2(g)反应生成1molH2O(g)放热为$\frac{1}{2}$×483.6kJ•mol-1=-241.8 kJ•mol-1,故A错误;
B.氢气的燃烧热是指1mol氢气完全燃烧生成液态水放出的热量,则氢气的燃烧热为:$\frac{483.6+88}{2}$=285.8kJ•mol-1,故B错误;
C.由图象分析,2H2(g)+O2(g)═H2O(l)△H1=-483.6kJ•mol-1①,
H2(g)=H2(l)△H1=-0.92kJ•mol-1②
O2(g)=O2(l)△H2=-6.84kJ•mol-1③
将①-②×2-③×2可得2H2(l)+O2(l)═2H2O(g)△H=-474.92kJ•mol-1,故C正确;
D.由图象可知,2molH2O(g)生成H2O(l)放出88kJ热量,则2H2O(g)=2H2O(l)△H=-88kJ•mol-1,即H2O(g)=H2O(l)△H=-44kJ•mol-1,故D错误;
故选C.
点评 本题综合考查化学反应与能量变化知识,为高频考点,题目难度中等,侧重于学生的分析能力和计算能力的考查,注意把握燃烧热的定义以及盖斯定律的应用,试题培养了学生的分析能力及灵活应用能力.

 考前必练系列答案
考前必练系列答案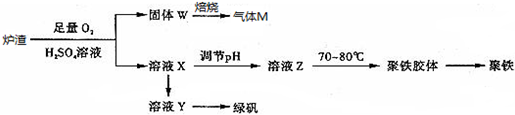
| A. | 炉渣中FeS与硫酸和氧气的反应的离子方程式为:4FeS+3O2+12H+═4Fe3++4S↓+6H2O | |
| B. | 溶液Z的pH影响聚铁中铁的质量分数,若其pH偏小,将导致聚铁中铁的质量分数偏大 | |
| C. | 气体M的成分是SO2,通入双氧水得到硫酸,可循环使用 | |
| D. | 向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再经蒸发浓缩、冷却结晶、过滤等步骤得到绿矾 |

已知ZnSO4的溶解度如表所示:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 100 |
| 溶解度/g | 41.6 | 47.5 | 53.8 | 61.3 | 70.5 | 75.4 | 71.1 | 60.5 |
(2)滤渣Ⅰ的主要成分为PbSO4.X的化学式为ZnO或Zn(OH)2.
(3)溶解过程中加入的稀硫酸的作用是制备ZnSO4并抑制ZnSO4水解.
(4)结晶的操作为蒸发浓缩、冷却结晶.
(5)用酒精进行洗涤的原因是减少硫酸锌晶体的损失,容易干燥.
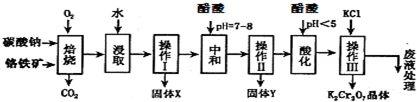
:①4FeO•Cr2O3+8Na2CO3+7O2 $\stackrel{750℃}{→}$8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3 $\stackrel{750℃}{→}$2NaAlO2+CO2↑;
③Cr2CO72-+H2O?2CrO42-+2H+
根据题意回答下列问题:
(1)固体X中主要含有Fe2O3、MgO(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用PH计或PH试纸(填写仪器或试剂名称).
(2)酸化步骤调节溶液pH<5,其目的是使CrO42-转化为Cr2O72-.
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是:
Na2Cr2O7+2KCl═K2Cr2O7↓+2NaCl
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度(g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
| 40℃ | 40.1 | 36.4 | 26.3 | 215 | |
| 80℃ | 51.3 | 38 | 73 | 376 | |
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量NaOH溶液(填写试剂)、溶解、过滤、再通入过量二氧化碳(填写试剂)、…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为$\frac{26m}{17n}$(用含m、n的代数式表示).
| A. | KNO3是钾盐、硝酸盐,也是正盐 | |
| B. | 漂白粉、明矾、铝热剂都是混合物 | |
| C. | 有机玻璃、氮化硅都是有机高分子材料 | |
| D. | CO、CO2、SO2均为酸性氧化物 |
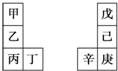 甲~辛等元素在周期表中的相对位置如右表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如右表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )| A. | 金属性:甲>乙>丁 | |
| B. | 最高价氧化物水化物酸性:戊<己 | |
| C. | 丙与庚的原子核外电子数相差13 | |
| D. | 乙的单质在空气中燃烧生成只含离子键的化合物 |
 Ⅰ:A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.
Ⅰ:A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等. .
.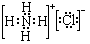 .
.