题目内容
17.下列离子组在一定条件下不能大量共存,且所给离子方程式能说明不能共存原因的是( )| 选项 | 条件 | 离子组 | 共存所发生的离子反应方程式 |
| A | pH=1的溶液 | Fe2+、Al3+、Cl-、MnO4- | 10Cl-+2MnO4-+16H+═2Mn2++5Cl2↑+8H2O |
| B | 能与铝反应生成氢气的溶液 | K+、NO3-、Cl-、NH4+ | NH4++OH-═NH3•H2O |
| C | 常温下c(H+)/c(OH)-=10-10的溶液 | Na+、Cl-、S2-、SO32- | SO32-+2S2-+6H+═3S↓+3H2O |
| D | 含有大量H+的透明溶液 | Na+、Cu2+、AlO2-、SiO32- | 2H++SiO32-═H2SiO3↓ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.pH=1的溶液,显酸性;
B.能与铝反应生成氢气的溶液,为非氧化性酸或强碱溶液;
C.常温下c(H+)/c(OH)-=10-10的溶液,显碱性;
D.含有大量H+的透明溶液,显酸性.
解答 解:A.pH=1的溶液,显酸性,Fe2+、MnO4-发生氧化还原反应不能共存,氯离子也能被高锰酸钾氧化,故A选;
B.能与铝反应生成氢气的溶液,为非氧化性酸或强碱溶液,碱溶液中不能大量存在NH4+,酸溶液中H+、NO3-、Al发生氧化还原反应不生成氢气,故B不选;
C.常温下c(H+)/c(OH)-=10-10的溶液,显碱性,该组离子之间不反应,可大量共存,故C不选;
D.含有大量H+的透明溶液,显酸性,Cu2+分别与AlO2-、SiO32-相互促进水解不能共存,且酸溶液中不能大量存在AlO2-、SiO32-,故D选;
故选AD.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
17.某新型“防盗玻璃”为多层结构,每层中间嵌有极细的金属线.当玻璃被击碎时,与金属线相连的警报系统就会立即报警.“防盗玻璃”能报警是利用了金属的( )
| A. | 延展性 | B. | 导电性 | C. | 弹性 | D. | 导热性 |
8.某化学兴趣小组用如图所示的药品和装置探究SO2气体的还原性:则下列说法不合理的是( )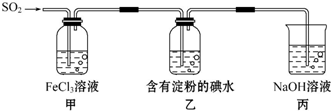

| A. | 为了验证Fe3+被SO2还原得到Fe2+,可向甲中加入KMnO4溶液,看紫红色是否褪去 | |
| B. | 甲中加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀说明SO2可以被Fe3+氧化 | |
| C. | 能表明I-的还原性弱于SO2的现象是乙中蓝色溶液褪色 | |
| D. | 装置丙的作用是吸收SO2尾气,防止污染空气 |
12.下列各组溶液,不另加其他试剂就可以将它们分别开的是( )
| A. | NaCl、HCl、NaAlO2、NaHCO3 | B. | NaSO4、KNO3、(NH4)2SO4、MgCl2 | ||
| C. | FeCl3、NaOH、AlCl3、HNO3 | D. | AgNO3、NaCl、NaSO4、NaI |
6.下列离子方程式正确的是( )
| A. | 镁与稀硝酸反应:Mg+2H+═Mg2++H2↑ | |
| B. | 氯化铝溶液与氨水反应:Al3++3OH-═Al(OH)3↓ | |
| C. | 三氯化铁腐蚀印刷线路板:2Fe3++Cu═2Fe2++Cu2+ | |
| D. | 硫酸溶液与氢氧化钡溶液反应:H++SO42-+OH-+Ba2+═BaSO4↓+H2O |
7.可逆反应A(g)+3B(g)?2C(g);△H=-Q kJ/mol.有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molA和3molB,在一定条件下达到平衡时放出热量为Q1 kJ在相同的条件下,向乙容器中加入2mol C达到平衡后吸收热量为Q2kJ,已知Q1=4Q2.下列叙述不正确的是( )
| A. | 乙中C的转化率为20% | |
| B. | Q1+Q2=Q | |
| C. | 达到平衡后,再向乙中加入0.25 molA、0.75molB、1.5molC,平衡向正反应方向移动 | |
| D. | 乙中的热化学反应方程式为2C(g)?A(g)+3B(g);△H=+Q2kJ•mol-1 |