题目内容
将铂丝插入KOH溶液中做电极,并在两极片上分别通入甲烷和氧气,形成一种燃料电池,在该电池反应中,甲烷发生类似于燃烧的反应,根据以上判断:
(1)通甲烷的铂丝为原电池的 极,发生的电极反应为 .
(2)该电池工作时(放电)反应的总化学方程式为 .
(1)通甲烷的铂丝为原电池的
(2)该电池工作时(放电)反应的总化学方程式为
考点:化学电源新型电池
专题:电化学专题
分析:(1)根据得失电子判断燃料电极的正负极,根据得失电子及产物的性质写出电极反应式;
(2)根据燃料燃烧及产物的性质写出电池反应式.
(2)根据燃料燃烧及产物的性质写出电池反应式.
解答:
解:(1)燃料燃烧时失电子发生氧化反应,原电池的负极上失电子发生氧化反应,所以通甲烷的铂丝为原电池的负极;甲烷燃烧生成二氧化碳和水,二氧化碳是酸性氧化物能和氢氧化钾反应生成碳酸钾和水,所以该电极上的电极反应式为:CH4+10OH--8e-=CO32-+7H2O,
故答案为:负;CH4+10OH--8e-=CO32-+7H2O;
(2)甲烷失电子发生氧化反应,氧气得电子发生还原反应,氧气得电子和水反应生成氢氧根离子,所以该反应的电池反应式为:CH4+2O2+2OH-=CO32-+3H2O;
故答案为:CH4+2O2+2OH-=CO32-+3H2O.
故答案为:负;CH4+10OH--8e-=CO32-+7H2O;
(2)甲烷失电子发生氧化反应,氧气得电子发生还原反应,氧气得电子和水反应生成氢氧根离子,所以该反应的电池反应式为:CH4+2O2+2OH-=CO32-+3H2O;
故答案为:CH4+2O2+2OH-=CO32-+3H2O.
点评:本题考查了燃料电池,燃料电池电极反应式的书写要注意结合电解质溶液书写,原料相同,电解质溶液不同,电极反应式不同,题目难度不大.

练习册系列答案
相关题目
实验室制Cl2反应为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O.下列说法不正确的是( )
| ||
| A、氧化剂是MnO2,还原剂是HCl |
| B、每生成1mol Cl2,转移电子的物质的量为2mol |
| C、每消耗1mol MnO2,起还原剂作用的HCl消耗4mol |
| D、转移电子的物质的量为1mol时,生成标准状况下Cl2的体积为11.2L |
不能达到除杂目的是( )
| A、乙醇(水):加入新制生石灰,蒸馏 |
| B、乙酸乙酯(乙醇):加入NaOH溶液,振荡静置后分液 |
| C、乙酸(乙醇):加入金属钠,蒸馏 |
| D、溴苯(溴):加入NaOH溶液,充分振荡静置后,分液 |
下列有关物质的性质和该性质的应用均正确的是( )
| A、常温下浓硫酸与铝不发生反应,可在常温下用铝制容器贮藏贮运浓硫酸 |
| B、二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| C、二氧化氯具有氧化性,可用于自来水的杀菌消毒 |
| D、铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀 |
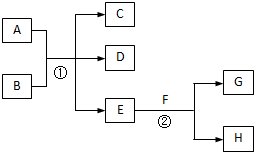 在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).
在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).