题目内容
2.瓦斯气中含有甲烷,它是煤矿安全生产的“大敌”,为防止瓦斯爆炸,需要不断地向坑道中鼓入空气以排除坑道内的瓦斯气.若将甲烷与空气混合于某容器中点燃,当爆炸最剧烈时,甲烷与空气的体积比为(同温、同压下)( )| A. | 1:2 | B. | 2:5 | C. | 1:10 | D. | 1:8 |
分析 由CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O可知,V(CH4):V(O2)=1:2,恰好完全反应,爆炸最为剧烈,空气中约含O2为20%,以此求得V(CH4):V(空气).
解答 解:由CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O可知,V(CH4):V(O2)=1:2,恰好完全反应,爆炸最为剧烈,空气中约含O2为20%,故V(CH4):V(空气)=1:$\frac{2}{20%}$=1:10.
故选C.
点评 本题考查化学方程式的有关计算,难度不大,明确同温同压下气V(CH4):V(O2)=1:2,恰好完全反应,爆炸最为剧烈是解题关键.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目
13.NO和CO都是汽车尾气力的有害物质,它们能缓慢反应,生成氮气和二氧化碳.为了控制大气污染,对此反应,下列叙述不正确的是( )
| A. | 改变温度对反应速率无影响 | |
| B. | 升高温度能加快反应速率 | |
| C. | 使用催化剂能加快反应速率 | |
| D. | 该反应的化学方程式为:2CO+2NO═N2+2CO2 |
7.某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如表所示数据(盐酸的物质的量浓度相等),下列分析推理不正确的是( )
| 盐酸的体积/mL | 50 | 50 | 50 |
| 混合物的质量/g | 9.2 | 15.7 | 27.6 |
| CO2的体积(标准 状况下)/L | 2.24 | 3.36 | 3.36 |
| A. | 盐酸的物质的量浓度为3.0 mol•L-1 | |
| B. | 根据表中数据能计算出混合物中NaHCO3的质量分数为45.65% | |
| C. | 加入混合物9.2 g时盐酸过量 | |
| D. | 15.7 g混合物恰好与盐酸完全反应 |
5.关于酯的下列说法正确的是( )
| A. | 酯有刺激性气味 | B. | 油脂属于酯类 | ||
| C. | 酯难溶于水且密度大于水 | D. | 酯化反应中用NaOH溶液做催化剂 |
6.目前,CO、CO2的有效开发利用成为科学家研究的重要课题.
Ⅰ.CO可用于合成甲醇
(1)已知:CO、H2、CH3OH(g)的燃烧热分别为-283kJ•mol-1、-285.8kJ•mol-1、-764.5kJ•mol-1,则CO(g)+2H2(g)?CH3OH(g)的△H=-90.1kJ•mol-1.
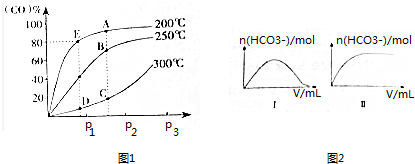
(2)将1molCO和2molH2充入密闭容器中发生上述反应.气体条件相同时,CO的平衡转化率[α(CO)]与压强(p)和温度(T)的关系如图1所示.
①A、B两点CH3OH的质量分数ω(A)>ω(B)(填“>”、“<”或“=”),理由为A点温度低于B点,该反应为放热反应,升高温度,平衡向逆反应方向移动.
②C、D两点的逆反应速率:v正(C)>v逆(D)(填“>”、“<”或“=”),理由为该反应为有气体参与的反应,C点压强大于D点,增大压强,反应速率越快.
③200℃时,测得E的容器容积为10L.该温度下,反应的平衡常数K=2500;保持温度和容积不变,再向容器中充入1molCO、1molH2和xmolCH3OH时,若使v正>v逆,则x的取值范围为0<x<58.
Ⅱ.CO2的综合利用
(3)CO2转化为甲醇有广泛应用前景.T℃时,在容积为1L的恒容密闭容器中,充入1molCO2和3molH2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,其它条件不变,下列措施中能使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大的是B(填选项字母).
A.升高温度 B.再充入1molCH3OH(g)和1molH2O(g) C.加入催化剂 D.再充入一定量CO2
(4)CO2可转化为碳酸盐,其中Na2CO3是一种用途广泛的碳酸盐.
已知:25℃时,几种酸的电离平衡常数如下表所示.
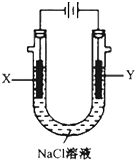
25℃时,向一定浓度的Na2CO3溶液中分别滴入等物质的量浓度的下列溶液至过量:①NaHC2O4②HNO3③HClO,溶液中的n(HCO3-)与所加入溶液体积(V)的关系如图2所示.其中,符合曲线Ⅰ的溶液为①②(填序号,下同);符合曲线Ⅱ的溶液为③.

Ⅰ.CO可用于合成甲醇
(1)已知:CO、H2、CH3OH(g)的燃烧热分别为-283kJ•mol-1、-285.8kJ•mol-1、-764.5kJ•mol-1,则CO(g)+2H2(g)?CH3OH(g)的△H=-90.1kJ•mol-1.
(2)将1molCO和2molH2充入密闭容器中发生上述反应.气体条件相同时,CO的平衡转化率[α(CO)]与压强(p)和温度(T)的关系如图1所示.
①A、B两点CH3OH的质量分数ω(A)>ω(B)(填“>”、“<”或“=”),理由为A点温度低于B点,该反应为放热反应,升高温度,平衡向逆反应方向移动.
②C、D两点的逆反应速率:v正(C)>v逆(D)(填“>”、“<”或“=”),理由为该反应为有气体参与的反应,C点压强大于D点,增大压强,反应速率越快.
③200℃时,测得E的容器容积为10L.该温度下,反应的平衡常数K=2500;保持温度和容积不变,再向容器中充入1molCO、1molH2和xmolCH3OH时,若使v正>v逆,则x的取值范围为0<x<58.
Ⅱ.CO2的综合利用
(3)CO2转化为甲醇有广泛应用前景.T℃时,在容积为1L的恒容密闭容器中,充入1molCO2和3molH2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,其它条件不变,下列措施中能使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大的是B(填选项字母).
A.升高温度 B.再充入1molCH3OH(g)和1molH2O(g) C.加入催化剂 D.再充入一定量CO2
(4)CO2可转化为碳酸盐,其中Na2CO3是一种用途广泛的碳酸盐.
已知:25℃时,几种酸的电离平衡常数如下表所示.
| H2CO3 | H2C2O4 | HNO2 | HClO |
| K1=4.4×10-7 K2=4.7×10-11 | K1=5.4×10-2 K2=5.3×10-5 | K=7.2×10-4 | K=2.9×10-8 |
 甲醚(CH3OCH3)被称为21试剂的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.
甲醚(CH3OCH3)被称为21试剂的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.
 .
.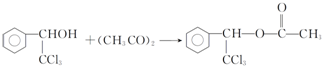 .
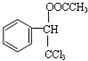
.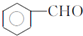 ,F与氯仿合成D的反应方程式为
,F与氯仿合成D的反应方程式为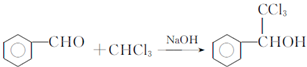 .已知2分子F在KCN存在下可通过授受H反应生成安息香
.已知2分子F在KCN存在下可通过授受H反应生成安息香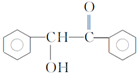 ,请写出上述反应方程式
,请写出上述反应方程式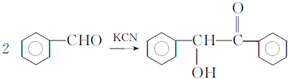 .
. 根据如图的物理模型,回答问题:
根据如图的物理模型,回答问题: