题目内容
铁及其化合物在生活、生产中有着广泛的应用.
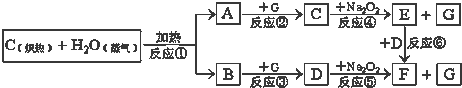
Ⅰ.铁触媒(+2价铁和+3价铁组成的氧化物)是工业合成氨的催化剂.某学习小组用下列流程测定铁触媒的含铁量.根据题意回答相关问题:
(1)步骤①中需用1.50mol?L-1的硫酸100mL,若用18.4mol?L-1的浓硫酸来配制,则需要用量筒量取浓硫酸 mL
(2)步骤②通入Cl2的目的是 (用离子方程式表示)
(3)步骤④后需用 (填仪器名称)取25.00mL稀释后溶液.
(4)步骤⑤消耗0.10mol?L-1的Na2SO3溶液25.00mL,则铁触媒中铁的质量分数为
Ⅱ.目前的研究表明,铁的某些含氧酸盐可用于工业废水、废气的处理.
用K2FeO4处理中性废水时与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,写出反应的离子反应方程式 ,处理废水时既利用K2FeO4强氧化性,又利用生成氢氧化铁胶体的 作用.

Ⅰ.铁触媒(+2价铁和+3价铁组成的氧化物)是工业合成氨的催化剂.某学习小组用下列流程测定铁触媒的含铁量.根据题意回答相关问题:
(1)步骤①中需用1.50mol?L-1的硫酸100mL,若用18.4mol?L-1的浓硫酸来配制,则需要用量筒量取浓硫酸
(2)步骤②通入Cl2的目的是
(3)步骤④后需用
(4)步骤⑤消耗0.10mol?L-1的Na2SO3溶液25.00mL,则铁触媒中铁的质量分数为
Ⅱ.目前的研究表明,铁的某些含氧酸盐可用于工业废水、废气的处理.
用K2FeO4处理中性废水时与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,写出反应的离子反应方程式
考点:探究物质的组成或测量物质的含量,离子方程式的书写,胶体的应用
专题:
分析:Ⅰ、(1)依据溶液中溶质不变计算得到;
(2)步骤②通入Cl2的目的是把亚铁离子氧化为铁离子;
(3)步骤④后的溶液显酸性,依据取用体积为25.00ml,则需用精确量具酸式滴定管取用;
(4)依据铁离子和亚硫酸钠溶液反应的定量关系计算铁元素质量分数;
Ⅱ、用K2FeO4处理中性废水时与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,铁元素化合价降低,氧元素化合价升高生成氧气,结合电荷守恒配平书写离子方程式;氢氧化铁胶体具有吸附作用.
(2)步骤②通入Cl2的目的是把亚铁离子氧化为铁离子;
(3)步骤④后的溶液显酸性,依据取用体积为25.00ml,则需用精确量具酸式滴定管取用;
(4)依据铁离子和亚硫酸钠溶液反应的定量关系计算铁元素质量分数;
Ⅱ、用K2FeO4处理中性废水时与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,铁元素化合价降低,氧元素化合价升高生成氧气,结合电荷守恒配平书写离子方程式;氢氧化铁胶体具有吸附作用.
解答:
解:Ⅰ、(1)步骤①中需用1.50mol?L-1的硫酸100mL,若用18.4mol?L-1的浓硫酸来配制,依据溶液稀释过程中溶质物质的量不变列式计算,1.50mol?L-1×0.100L=18.4mol?L-1×V,V=0.0082L=8.2ml,则需要用量筒量取浓硫酸.2ml;故答案为:8.2;
(2)步骤②通入Cl2的目的是氧化亚铁离子为铁离子,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(3)步骤④后的溶液显酸性,依据取用体积为25.00mL,则需用精确量具酸式滴定管取用,故答案为:酸式滴定管;
(4)步骤⑤消耗0.10mol?L-1的Na2SO3溶液25.00mL,
SO32-+2Fe3++H2O=2Fe2++2H++SO42-
1 2
0.10mol/L×0.025L n
n=0.05mol,250ml溶液中铁元素物质的量=0.05mol×
=0.5mol,则铁触媒中铁的质量分数为
×100%=35.7%,故答案为:35.7%;
Ⅱ.用K2FeO4处理中性废水时与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,铁元素化合价降低,氧元素化合价升高生成氧气,结合电荷守恒配平书写离子方程式为:4FeO42-+10H2O=4Fe(OH)3(胶体)+8OH-+3O2↑;氢氧化铁胶体具有吸附作用,能吸附悬浮在水中的杂质净水,发生聚沉;
故答案为:4FeO42-+10H2O=4Fe(OH)3(胶体)+8OH-+3O2↑;聚沉.
(2)步骤②通入Cl2的目的是氧化亚铁离子为铁离子,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(3)步骤④后的溶液显酸性,依据取用体积为25.00mL,则需用精确量具酸式滴定管取用,故答案为:酸式滴定管;
(4)步骤⑤消耗0.10mol?L-1的Na2SO3溶液25.00mL,
SO32-+2Fe3++H2O=2Fe2++2H++SO42-
1 2
0.10mol/L×0.025L n
n=0.05mol,250ml溶液中铁元素物质的量=0.05mol×
| 250 |
| 25 |
| 0.5mol×56g/mol |
| 7.84g |
Ⅱ.用K2FeO4处理中性废水时与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,铁元素化合价降低,氧元素化合价升高生成氧气,结合电荷守恒配平书写离子方程式为:4FeO42-+10H2O=4Fe(OH)3(胶体)+8OH-+3O2↑;氢氧化铁胶体具有吸附作用,能吸附悬浮在水中的杂质净水,发生聚沉;
故答案为:4FeO42-+10H2O=4Fe(OH)3(胶体)+8OH-+3O2↑;聚沉.
点评:本题考查了物质性质的分析,物质组成的实验探究方法和实验过程分析判断,氧化还原反应实质理解和化学式变化的计算应用,掌握基础是关键,题目难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
有标准状况下24mL H2和O2的混合气体,在一定条件下点燃后恢复到原状态仅剩余3mL气体(该气体可使带火星木条复燃),则原混合气体中H2和O2的分子个数之比为( )
| A、1:16 | B、16:1 |
| C、17:7 | D、7:5 |
等质量的镁和铝分别与足量的稀盐酸反应后,在相同状况下生成的气体的体积比是( )
| A、1:1 | B、4:3 |
| C、2:3 | D、3:4 |
用下列装置进行相应实验,能达到实验目的是( )
A、 用图能证明酸性:硫酸>碳酸>次氯酸 |
B、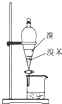 用图所示装置分离出溴苯 |
C、 用图设计成铜锌原电池装置 |
D、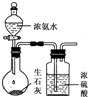 用图制取干燥的氨气 |
下列分子中所有原子不可能共同处在同一平面上的是( )
A、 |
| B、HC≡C-C≡CH |
| C、CH2=CHCl |
| D、H2CO3 |