题目内容
根据下面物质间转换的框图,回答有关问题:
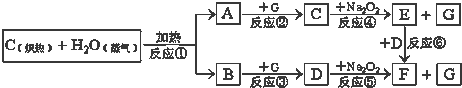
(1)由反应①产生的A、B混合物的工业名称是 .
(2)写出框图中D、E的化学式:D ;E
(3)如果2mol Na2O2与足量水蒸气反应,可得标准状况下气体的体积是 L,同时反应中转移电子总数是 .(NA表示阿佛加德罗常数)
(4)如果A、B混合气体7.8g(平均摩尔质量10g?mol-1),在与G充分反应后,通过足量Na2O2层,可使Na2O2增重 g,并得到O2 mol.

(1)由反应①产生的A、B混合物的工业名称是
(2)写出框图中D、E的化学式:D
(3)如果2mol Na2O2与足量水蒸气反应,可得标准状况下气体的体积是
(4)如果A、B混合气体7.8g(平均摩尔质量10g?mol-1),在与G充分反应后,通过足量Na2O2层,可使Na2O2增重
考点:无机物的推断
专题:
分析:碳和水蒸气反应生成一氧化碳和氢气,由C+Na2O2→E+G,D+Na2O2→F+G,故G为O2,一氧化碳和氧气反应生成二氧化碳,氢气和氧气反应生成水,二氧化碳和过氧化钠反应生成碳酸钠和氧气,水和过氧化钠反应生成氢氧化钠和氧气,由E与D反应得到F,所以E是NaOH,D是CO2,F是Na2CO3,C是H2O,则A为H2,B为CO,据此解答.
解答:
解:碳和水蒸气反应生成一氧化碳和氢气,由C+Na2O2→E+G,D+Na2O2→F+G,故G为O2,一氧化碳和氧气反应生成二氧化碳,氢气和氧气反应生成水,二氧化碳和过氧化钠反应生成碳酸钠和氧气,水和过氧化钠反应生成氢氧化钠和氧气,由E与D反应得到F,所以E是NaOH,D是CO2,F是Na2CO3,C是H2O,则A为H2,B为CO,
(1)高温条件下,碳和水反应生成一氧化碳和氢气,混合物的工业名称是水煤气,故答案为:水煤气;
(2)通过以上分析知,D是CO2,E是NaOH,故答案为:CO2;NaOH;
(3)由2Na2O2+2H2O=4NaOH+O2 ↑,可知2mol Na2O2与足量水蒸气反应生成氧气为2mol×
=1mol,标况下氧气的体积为1mol×22.4L/mol=22.4L,反应中O元素化合价由-1价升高为氧气中0价,转移电子为1mol×2×NAmol-1=2NA,故答案为:22.4;2NA;
(4)一氧化碳、氢气与氧气反应生成二氧化碳、水,由2Na2O2+2H2O=4NaOH+O2 ,2Na2O2+2CO2=2Na2CO3+O2 可知,过氧化钠增重等于CO与H2的质量,故过氧化钠增重7.8g;
设混合物中一氧化碳的物质的量是n1,氢气的物质的量是n2,则
=10,整理的n1:n2=4:9,由二者质量有28n1+2n2=7.8,联立解得n1=0.24,n2=0.54,
根据元素守恒CO、H2与O2反应后生成0.24molCO2,0.54molH2O,由2Na2O2+2H2O=4NaOH+O2 ,2Na2O2+2CO2=2Na2CO3+O2 可知,生成氧气的体积为
×0.24mol+
×0.54mol=0.39mol;
故答案为:7.8;0.39.
(1)高温条件下,碳和水反应生成一氧化碳和氢气,混合物的工业名称是水煤气,故答案为:水煤气;
(2)通过以上分析知,D是CO2,E是NaOH,故答案为:CO2;NaOH;
(3)由2Na2O2+2H2O=4NaOH+O2 ↑,可知2mol Na2O2与足量水蒸气反应生成氧气为2mol×
| 1 |
| 2 |
(4)一氧化碳、氢气与氧气反应生成二氧化碳、水,由2Na2O2+2H2O=4NaOH+O2 ,2Na2O2+2CO2=2Na2CO3+O2 可知,过氧化钠增重等于CO与H2的质量,故过氧化钠增重7.8g;
设混合物中一氧化碳的物质的量是n1,氢气的物质的量是n2,则
| 28n1+2n2 |
| n1+n2 |
根据元素守恒CO、H2与O2反应后生成0.24molCO2,0.54molH2O,由2Na2O2+2H2O=4NaOH+O2 ,2Na2O2+2CO2=2Na2CO3+O2 可知,生成氧气的体积为
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:7.8;0.39.
点评:本题考查无机物推断、化学计算等,难度中等,注意(4)中氧气的物质的量可以利用方程式观察,结合元素守恒,氧气的物质的量为一氧化碳、氢气混合气体的一半.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
室温下某透明溶液中由水电离产生的H+和OH-浓度的乘积为=1×10-24mol2?L-2,满足此条件的溶液中一定可以大量共存的离子组是( )
| A、MnO4- Na+ SO42-K+ |
| B、Fe2+ Na+ Cl- NO3- |
| C、K+ Na+ Cl- CO32- |
| D、K+ NH4+ SO42- NO3- |
将十水碳酸钠与碳酸氢钠的混合物4.54g溶于水,配成100ml溶液.测得溶液中钠离子的物质的量浓度为0.4mol/L,在溶液中加入过量的盐酸,完全反应后,将溶液蒸干灼烧至质量不变,则所得固体的质量为( )
| A、4.54g |
| B、3.34g |
| C、2.57g |
| D、2.34g |
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图.下列说法不正确的是( )

| A、离子半径的大小顺序为:r(W2-)>r(Q-)>r(Y2-)>r(Z3+) |
| B、元素W的最高价氧化物对应水化物的酸性比Q的强 |
| C、元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键 |
| D、X、Y形成的化合物是大气污染物之一 |
下列关于各实验装置的叙述中正确的是( )
A、 常用于分离互不相溶液体混合物 |
B、 可用于吸收HCl气体,并能防倒吸 |
C、 可用于实验室制NH3 |
D、 b口进气可收集CO2、NO等气体 |
已知常温下,浓度均为0.1mol?L-1的4种钠盐溶液pH如下表:下列说法中正确的是( )
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
| A、足量SO2通入NaClO溶液中发生反应的离子方程式为:H2O+SO2+ClO-=HClO+HSO3- |
| B、向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度 |
| C、常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,pH最大的是H2SO3 |
| D、NaHSO3溶液中离子浓度大小顺序为:c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-) |
