题目内容
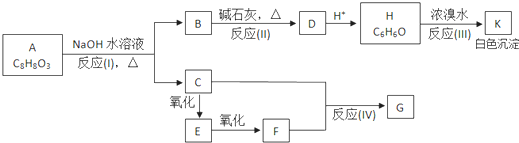
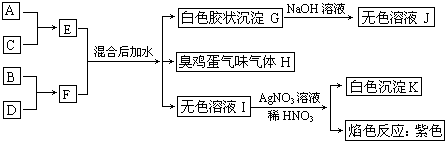
A、B、C、D四种元素原子核电荷数依次增大(均小于20),其单质及相应的化合物能发生如下反应关系:
(1)写出四种元素元素符号:A、 B、 C、 D、 .
(2)F的电子式: .
(3)写出E、F混合后加水的化学方程式: .
(4)写出G→J的化学方程式: .
(5)写出C单质与H水溶液反应的离子方程式: .

(1)写出四种元素元素符号:A、
(2)F的电子式:
(3)写出E、F混合后加水的化学方程式:
(4)写出G→J的化学方程式:
(5)写出C单质与H水溶液反应的离子方程式:
考点:无机物的推断
专题:有机物的化学性质及推断
分析:A、B、C、D四种元素原子的核电荷数均小于20,G是白色胶状沉淀,溶于氢氧化钠溶液,G为Al(OH)3,J为NaAlO2,H为臭鸡蛋气味的气体,则H为H2S,无色溶液I与硝酸银、硝酸反应生成白色沉淀K,K为AgCl,溶液进行焰色反应为紫色,可以K元素,故I为KCl;根据元素守恒,结合E+F
Al(OH)3+H2S+KCl,可知A、B、C、D四种元素为Al、S、Cl、K,而A、B、C、D四种元素原子的核电荷数依次增大,故A为Al,B为S,C为Cl,D为K,由A+C→E可知,E为AlCl3,由B+D→F可知,F为K2S,据此解答.
| 水 |
解答:
解:A、B、C、D四种元素原子的核电荷数均小于20,G是白色胶状沉淀,溶于氢氧化钠溶液,G为Al(OH)3,J为NaAlO2,H为臭鸡蛋气味的气体,则H为H2S,无色溶液I与硝酸银、硝酸反应生成白色沉淀K,K为AgCl,溶液进行焰色反应为紫色,可以K元素,故I为KCl;根据元素守恒,结合E+F
Al(OH)3+H2S+KCl,可知A、B、C、D四种元素为Al、S、Cl、K,而A、B、C、D四种元素原子的核电荷数依次增大,故A为Al,B为S,C为Cl,D为K,由A+C→E可知,E为AlCl3,由B+D→F可知,F为K2S,
(1)由上述分析可知,A为Al,B为S,C为Cl,D为K,故答案为:Al;S;Cl;K;
(2)F为K2S,属于离子化合物,由钾离子与硫离子构成,电子式为: ,故答案为:
,故答案为: ;
;
(3)AlCl3、K2S混合后加水的化学方程式:2AlCl3+3K2S+6H2O=2Al(OH)3↓+3H2S↑+6KCl,故答案为:2AlCl3+3K2S+6H2O=2Al(OH)3↓+3H2S↑+6KCl;
(4)G→J的化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O,故答案为:Al(OH)3+NaOH=NaAlO2+2H2O;
(5)C单质为氯气,与硫化氢水溶液反应生成S与HCl,反应离子方程式为:Cl2+H2S=S↓+2H++2Cl-,故答案为:Cl2+H2S=S↓+2H++2Cl-.
| 水 |
(1)由上述分析可知,A为Al,B为S,C为Cl,D为K,故答案为:Al;S;Cl;K;
(2)F为K2S,属于离子化合物,由钾离子与硫离子构成,电子式为:
 ,故答案为:
,故答案为: ;
;(3)AlCl3、K2S混合后加水的化学方程式:2AlCl3+3K2S+6H2O=2Al(OH)3↓+3H2S↑+6KCl,故答案为:2AlCl3+3K2S+6H2O=2Al(OH)3↓+3H2S↑+6KCl;
(4)G→J的化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O,故答案为:Al(OH)3+NaOH=NaAlO2+2H2O;
(5)C单质为氯气,与硫化氢水溶液反应生成S与HCl,反应离子方程式为:Cl2+H2S=S↓+2H++2Cl-,故答案为:Cl2+H2S=S↓+2H++2Cl-.
点评:本题以无机框图题的形式考查元素化合物推断,涉及Al、S、Cl等元素单质及其化合物之间的相互转化,“H为臭鸡蛋气味的气体,G是白色胶状沉淀且与氢氧化钠反应,I溶液焰色反应为紫色”等均为解题突破口,难度不大.

练习册系列答案
相关题目
下列叙述中正确的是( )
| A、不可用澄清石灰水鉴别Na2CO3和NaHCO3溶液 |
| B、1mol过氧化钠与2 mol碳酸钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是纯净物 |
| C、等质量的NaHCO3和Na2 CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同 |
| D、可利用焰色反应来鉴别Na2CO3和NaHCO3固体 |
下列有关实验的说法错误的是( )
| A、做银镜反应实验后的试管内壁附有银,可用稀硝酸清洗 |
| B、向MgCl2溶液中滴加NaOH溶液,产生白色沉淀,再加入FeCl3溶液,沉淀逐渐变为红褐色 |
| C、用0.1mol/L的酸性KMnO4溶液配成的溶液滴定一定质量的草酸晶体(H2C2O4?nH2O)以测定其n值,若终点仰视读数,则n值偏大 |
| D、环形玻璃搅拌棒材料若用铜代替,则测量出的中和热数值偏小 |
一定条件下,在体积为2L的密闭容器中,3molX和3mol Y发生反应:3X(g)+Y(g)═2Z(g),经60s达到平衡,生成0.4molZ.下列说法正确的是( )
| A、60s内反应速率为v(X)=0.05 mol/(L?s),X的转化率为80% | ||
B、其它条件不变,将容器体积变为4L,Z的平衡浓度变为原来的
| ||
| C、其它条件不变,若升高温度,X的体积分数增大,则该反应的△H>0 | ||
| D、其它条件不变,若初始投入2mol X和2mol Y则物质Y的转化率减小 |