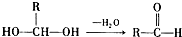题目内容
配制一定浓度的NaOH溶液时,下列操作使所配溶液浓度偏低的有几个:( )
①容量瓶中的原有蒸馏水未除去
②溶解用的烧杯未经洗涤
③定容时观察液面俯视
④用胶头滴管向容量瓶加水时,水未到刻度线即停止加水
⑤所用的NaOH中混有Na2CO3
⑥用托盘天平称取一定质量的NaOH时,所用的小烧杯内壁不太干燥
⑦NaOH在烧杯中溶解后立即将溶液转移到容量瓶内.
①容量瓶中的原有蒸馏水未除去
②溶解用的烧杯未经洗涤
③定容时观察液面俯视
④用胶头滴管向容量瓶加水时,水未到刻度线即停止加水
⑤所用的NaOH中混有Na2CO3
⑥用托盘天平称取一定质量的NaOH时,所用的小烧杯内壁不太干燥
⑦NaOH在烧杯中溶解后立即将溶液转移到容量瓶内.
| A、1 | B、2 | C、3 | D、4 |
考点:配制一定物质的量浓度的溶液
专题:实验题
分析:分析操作对溶质物质的量、溶液体积的影响,根据c=
判断对所配溶液浓度的影响.
| n |
| V |
解答:
解:①转移溶液前容量瓶内有少量蒸馏水对所配溶液的浓度无影响;
②移液后烧杯及玻璃棒未用蒸馏水洗涤,会导致溶质的损失,故使所配溶液浓度偏低;
③定容时,俯视容量瓶的刻度线,会导致溶液体积偏小,故使所配溶液浓度偏高;
④定容时水没达到刻度线,会导致溶液体积偏小,故使所配溶液浓度偏高;
⑤所用的NaOH中混有Na2CO3,导致n偏小,溶液浓度偏低;
⑥氢氧化钠具有吸水性,小烧杯内壁不太干燥,导致称量的氢氧化钠质量减小,n减小,溶液浓度偏低;
⑦NaOH固体的溶解放热,故在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中并定容的话,会导致冷却后液面低于刻度线,溶液体积偏小,浓度偏高.
所配溶液浓度偏低的有3项,
故选C.
②移液后烧杯及玻璃棒未用蒸馏水洗涤,会导致溶质的损失,故使所配溶液浓度偏低;
③定容时,俯视容量瓶的刻度线,会导致溶液体积偏小,故使所配溶液浓度偏高;
④定容时水没达到刻度线,会导致溶液体积偏小,故使所配溶液浓度偏高;
⑤所用的NaOH中混有Na2CO3,导致n偏小,溶液浓度偏低;
⑥氢氧化钠具有吸水性,小烧杯内壁不太干燥,导致称量的氢氧化钠质量减小,n减小,溶液浓度偏低;
⑦NaOH固体的溶解放热,故在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中并定容的话,会导致冷却后液面低于刻度线,溶液体积偏小,浓度偏高.
所配溶液浓度偏低的有3项,
故选C.
点评:本题考查一定物质的量浓度溶液的配制,难度不大,注意浓硫酸的稀释,根据c=
理解溶液配制原理与误差分析.
| n |
| V |

练习册系列答案
相关题目
某溶液中加入BaCl2溶液,生成不溶于稀盐酸的白色沉淀,则溶液中溶有的离子是( )
| A、一定溶有CO32- |
| B、一定溶有SO42- |
| C、一定溶有Ag+ |
| D、可能溶有SO42-或Ag+ |
下列反应的离子方程式书写正确的是 ( )
| A、氨气通入醋酸溶液中 CH3COOH+NH3═CH3COONH4 |
| B、澄清的石灰水跟盐酸反应 H++OH-═H2O |
| C、碳酸钡溶于醋酸 BaCO3+2H+═Ba2++H2O+CO2↑ |
| D、金属钠跟水反应 2Na+2H2O═2Na++2OH-+H2↑ |


 已知一个碳原子上连有两个羟基时,易发生下列转化:
已知一个碳原子上连有两个羟基时,易发生下列转化: