题目内容
6.下列有关性质的比较,正确的是 ( )| A. | 第一电离能:O>N | B. | 水溶性:CH3CH2OH>CH3OCH3 | ||
| C. | 沸点:H2S>H2O | D. | 晶格能:NaCl>MgO |
分析 A.氮元素的最外层电子排布为半充满状态,是一种稳定结构,所以氮的第一电离能要大于相邻的同周期元素;
B.根据相似相溶原理,极性分子易溶于极性分子溶剂中;
C.考虑氢键和分子间作用力的区别;
D.电荷越大,离子半径越小,则晶格能越大.
解答 解:A.氮元素的最外层电子排布为半充满状态,是一种稳定结构,所以氮的第一电离能要大于相邻的同周期元素,所以第一电离能N>O,故A错误;
B.CH3CH2OH和H2O为极性分子,CH3OCH3为非极性分子,所以水溶性:CH3CH2OH>CH3OCH3,故B正确;
C.H2S分子间只存在范德华力,水分子间中存在氢键,沸点较高,故沸点:H2O>H2S,故C错误;
D.电荷越大,离子半径越小,则晶格能越大,则晶格能为NaCl<MgO,故D错误.
故选:B.
点评 本题考查物质结构与性质,为选修三中高频考点,把握第一电离能、熔沸点、水溶性、晶格能的比较方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
16.各有机物的名称肯定错误的是( )
| A. | 2,2-二甲基丙烷 | B. | 3-甲基-2-丁烯 | C. | 4-甲基-1-戊炔 | D. | 1,3-二甲基苯 |
17.下列叙述正确的是( )
| A. | 分子式为C4H8的有机物可能存在4个C-C单键 | |
| B. |  、 、 和 和 均属于芳香烃 均属于芳香烃 | |
| C. |  和 和 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 | |
| D. | 结构简式为C2H5-OH的核磁共振氢谱上有2个吸收峰 |
14.已知在25℃、1.0×105Pa条件下,2mol氢气燃烧生成水蒸气放出484KJ热量,下列热化学方程式正确的是( )
| A. | H2(g)+$\frac{1}{2}$ O2(g)═H2O(g)△H=+242 kJ/mol | B. | 2H2(g)+O2(g)═2H2O(l)△H=-484kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$ O2(g)═H2O(g)△H=-242kJ/mol | D. | 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ/mol |
18.下列有关说法错误的是( )
| A. |  和 和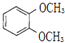 不属于同分异构体的 不属于同分异构体的 | |
| B. | 质量相同的C3H6 和C2H6完全燃烧时消耗氧气的质量较少的是C3H6 | |
| C. | 连接四个不同基团的碳原子为“手性碳原子”,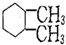 含有两个手性碳原子 含有两个手性碳原子 | |
| D. | 标准状况下22.4 L溴乙烷所含化学键总数为7NA |
15.下列化学用语正确的是( )
| A. | 乙烯的结构简式为:CH2CH2 | B. | 苯的分子式为:C6H6 | ||
| C. | 四氯化碳的电子式为 | D. | 丙烷分子的比例模型  |
16.0.1mol•L-1的H2S溶液中存在着电离平衡H2S?H++HS-;HS-?S2-+H+.下列叙述中错误的是( )
| A. | 从阴离子HS-电离出H+比从H2S电离出H+更难 | |
| B. | H2S电离出的H+会抑制HS-的电离 | |
| C. | 溶液中c(H+)与c(HS-)接近于相等且c(H+)略大于c(HS-) | |
| D. | 溶液中c(H+)=2c(S2-) |

 和
和 .
. .
.