题目内容
1.pH=13的CH3COONa溶液加水稀释100倍后,pH>11(填“>”“=”或“<”)原因是加水稀释使平衡CH3COO-+H2O?CH3COOH+OH-右移,氢氧根离子浓度略有增大(用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH>NaOH溶液的pH(填“>”“=”或“<”).分析 醋酸钠溶液中醋酸根离子水解,溶液显碱性,加水稀释促进水解,平衡正向进行,氢氧化钠为强碱溶液,醋酸钠为强碱弱酸盐,加热后氢氧化钠溶液的pH基本不变,而醋酸钠的水解程度增大,溶液pH增大.
解答 解:pH=13的CH3COONa溶液加水稀释100倍后,如果没有水解平衡,PH值会变化2个单位,但醋酸根离子存在水解平衡:CH3COO-+H2O?CH3COOH+OH-,加水稀释后醋酸根离子的水解程度增大,氢氧根离子浓度略有增大,则溶液的pH>11;
pH相等的NaOH溶液与CH3COONa溶液,醋酸钠为强碱弱酸盐,醋酸根离子水解溶液显示碱性,加热后醋酸根离子的水解程度增大,则溶液pH增大,所以分别加热到相同的温度后CH3COONa溶液的pH>NaOH溶液的pH,
故答案为:>;加水稀释使平衡CH3COO-+H2O?CH3COOH+OH-右移,氢氧根离子浓度略有增大;>.
点评 本题考查了盐类水解的原理分析应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
12.下列比较错误的是( )
| A. | 原子半径:N>O>F | B. | 酸性强弱:H2SO4>H2SiO3>H2CO3 | ||
| C. | 碱性强弱:KOH>NaOH>Mg(OH)2 | D. | 氢化物的稳定性:HF>HCl>H2S |
16.下列说法正确的是( )
| A. | MgCl2晶体中的化学键是离子键 | |
| B. | 某物质在熔融态能导电,则该物质中一定含有离子键 | |
| C. | H2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 干冰是分子晶体,其溶于水生成碳酸的过程只需克服分子间作用力 |
6.下列有关性质的比较,正确的是 ( )
| A. | 第一电离能:O>N | B. | 水溶性:CH3CH2OH>CH3OCH3 | ||
| C. | 沸点:H2S>H2O | D. | 晶格能:NaCl>MgO |
10.下列做法符合节能减排的是( )
①改进废气回收利用技术
②安装太阳能热水器为居民提供热水
③发展火力发电,解决电力短缺问题
④用杂草、麦秆等有机废弃物在沼气池中发酵产生沼气,用作家庭燃气.
①改进废气回收利用技术
②安装太阳能热水器为居民提供热水
③发展火力发电,解决电力短缺问题
④用杂草、麦秆等有机废弃物在沼气池中发酵产生沼气,用作家庭燃气.
| A. | ①③ | B. | ②④ | C. | ①②④ | D. | ②③④ |
11.已知lg2=0.3,在不同温度下,水达到电离平衡时c(H+)与c(OH-)的关系如图所示,下列说法中正确的是( )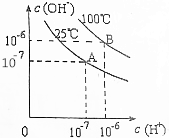

| A. | 25℃时,0.1mol/LNaOH溶液与0.1mol/L乙酸溶液等体积混合,所得溶液的pH等于7 | |
| B. | 25℃时,pH=11的氨水与pH=3的盐酸等体积混合,所得溶液的pH小于7 | |
| C. | 100℃时,pH=12的NaOH溶液aL和pH=2的H2SO4溶液bL恰好中和,则a:b=1:1 | |
| D. | 100℃时,pH=12的NaOH溶液和pH=9的NaOH溶液等体积混合,所得溶液的pH约为11.7 |
