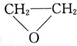
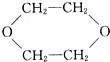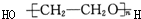题目内容
9.下列关于铝及其化合物的离子方程式不正确的是( )| A. | AlCl3溶液中加入过量稀氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ | |
| B. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO${\;}_{2}^{-}$+2H2O═Al(OH)3↓+HCO${\;}_{3}^{-}$ | |
| C. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO${\;}_{2}^{-}$+3H2↑ | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO${\;}_{4}^{2-}$恰好完全沉淀:2Ba2++3OH-+Al3++2SO${\;}_{4}^{2-}$═2BaSO4↓+Al(OH)3↓ |
分析 A.二者反应生成氢氧化铝沉淀和氯化铵;
B.二氧化碳过量,反应生成氢氧化铝沉淀和碳酸氢钠;
C.铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
D.硫酸根离子恰好沉淀时,铝离子与氢氧根离子的物质的量之比为1:4,二者反应生成偏铝酸根离子.
解答 解:A.AlCl3溶液中加入过量NH3•H2O的离子反应为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故A正确;
B.向NaAlO2溶液中通入过量CO2制Al(OH)3离子反应为:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,故B正确;
C.铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,离子方程式:2Al+2OH-+2H2O═2AlO2-+3H2↑,故C正确;
D.明矾[KAl(SO4)2]溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀,硫酸铝钾与氢氧化钡的物质的量之比为1:2,反应生成偏铝酸钠,正确的离子方程式为:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O,故D错误;
故选:D.
点评 本题考查了离子方程式的判断,为中等难度的试题,注意掌握离子方程式的书写原则、熟悉铝及其化合物性质是解题关键,题目难度中等.

练习册系列答案
相关题目
19.C4H9Cl的同分异构体有几种( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
17.下列各组微粒,在溶液中可以大量共存的是( )
| A. | OH-、K+、CO32-、Cl2 | B. | Na+、OH-、NH4+、Cl- | ||
| C. | Fe3+、Na+、NH3.H2O、NO3- | D. | K+、Al3+、Cl-、SO42- |
4. 在体积为V L的恒容密闭容器中加入6mol CO和H2的混合气体,在不同条件下发生反应:CO(g)+2H2(g)═CH3OH(g).图甲表示有、无催化剂时反应的能量变化,图乙表示平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系(图中I、II、III点均处于曲线上).下列叙述正确的是( )
在体积为V L的恒容密闭容器中加入6mol CO和H2的混合气体,在不同条件下发生反应:CO(g)+2H2(g)═CH3OH(g).图甲表示有、无催化剂时反应的能量变化,图乙表示平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系(图中I、II、III点均处于曲线上).下列叙述正确的是( )
 在体积为V L的恒容密闭容器中加入6mol CO和H2的混合气体,在不同条件下发生反应:CO(g)+2H2(g)═CH3OH(g).图甲表示有、无催化剂时反应的能量变化,图乙表示平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系(图中I、II、III点均处于曲线上).下列叙述正确的是( )
在体积为V L的恒容密闭容器中加入6mol CO和H2的混合气体,在不同条件下发生反应:CO(g)+2H2(g)═CH3OH(g).图甲表示有、无催化剂时反应的能量变化,图乙表示平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系(图中I、II、III点均处于曲线上).下列叙述正确的是( )| A. | 该反应的热化学方程式为CO(g)+2H2(g)═CH3OH(g)△H=91 kJ•mol-1,曲线b表示使用了催化剂 | |
| B. | 反应速率:v (Ⅱ)<v (Ⅲ) | |
| C. | 平衡时CO的转化率:α(Ⅰ)<α(Ⅱ) | |
| D. | n(CO):n(H2)=0.5时,平衡时CH3OH的物质的量浓度:c(CH3OH,100℃)<c(CH3OH,200℃) |
1.在国际环境问题中,一次性使用的聚苯乙烯材料带来的“白色污染”甚为突出.这种材料难以分解,处理麻烦.最近研究制出一种新型的材料能替代聚苯乙烯.它是由乳酸缩聚而生成的,该种材料可在乳酸菌作用下发生降解,下列关于聚乳酸的说法正确的是( )
| A. | 聚乳酸是一种纯净物 | B. | 其聚合方式与聚苯乙烯相似 | ||
| C. | 其单体为 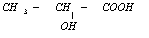 | D. | 聚乳酸是一种线型高分子材料 |
18.科学家对物质性质的推断一般要基于一些实验事实.下列能说明苯与一般的烯烃性质不同的实验事实是( )
| A. | 苯分子是高度对称的平面形分子 | |
| B. | 苯与溴水混合无明显现象 | |
| C. | 苯不与酸性KMnO4溶液反应 | |
| D. | 1 mol C6H6在一条件下可与3 mol Cl2发生加成反应 |