题目内容
4. 在体积为V L的恒容密闭容器中加入6mol CO和H2的混合气体,在不同条件下发生反应:CO(g)+2H2(g)═CH3OH(g).图甲表示有、无催化剂时反应的能量变化,图乙表示平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系(图中I、II、III点均处于曲线上).下列叙述正确的是( )
在体积为V L的恒容密闭容器中加入6mol CO和H2的混合气体,在不同条件下发生反应:CO(g)+2H2(g)═CH3OH(g).图甲表示有、无催化剂时反应的能量变化,图乙表示平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系(图中I、II、III点均处于曲线上).下列叙述正确的是( )| A. | 该反应的热化学方程式为CO(g)+2H2(g)═CH3OH(g)△H=91 kJ•mol-1,曲线b表示使用了催化剂 | |
| B. | 反应速率:v (Ⅱ)<v (Ⅲ) | |
| C. | 平衡时CO的转化率:α(Ⅰ)<α(Ⅱ) | |
| D. | n(CO):n(H2)=0.5时,平衡时CH3OH的物质的量浓度:c(CH3OH,100℃)<c(CH3OH,200℃) |
分析 A、反应物的能量高于产物能量,反应是放热反应,加催化剂可以降低活化能,加快反应速率;
B、温度越高反应速率越快;
C、增加反应物氢气的投料,促进平衡正向移动,提高CO的转化率;
D、升高温度,促进平衡向吸热方向移动,据此回答.
解答 解:A、图示中反应物的能量高于产物能量,反应是放热反应,故A错误;
B、反应温度:状态Ⅱ<状态Ⅲ,温度越高反应速率越快,所以正反应速率v正:v (Ⅱ)<v (Ⅲ,故B正确;
C、状态Ⅱ相当于增加反应物氢气的投料,促进平衡正向移动,提高CO的转化率,α(Ⅰ)<α(Ⅱ),故C正确;
D、n(CO):n(H2)=0.5时,升高温度,200℃促进平衡在100℃的基础上逆向移动,甲醇浓度会减小,所以c(CH3OH,1 00℃)>c(CH3OH,200℃),故D错误;
故选BC.
点评 本题综合考查反应热的判断、影响化学反应速率和平衡移动的因素等知识,属于综合知识的考查,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.下列说法正确的是( )
| A. | 摩尔是一种物理量 | B. | Cl2的摩尔质量是71g | ||
| C. | 1molO2的体积是22.4L | D. | 36gH2O含有的分子数为2NA |
15.下列有关阿伏加德罗常数(NA)的说法错误的是( )
| A. | 44 g CO2所含的原子数为NA | |
| B. | 0.5 mol H2O含有的原子数目为1.5NA | |
| C. | 1 mol H2O含有的H2O分子数目为NA | |
| D. | 0.5NA个O2的物质的量是0.5 mol |
12.有下列高分子化合物:

其中由两种不同单体聚合而成的是( )

其中由两种不同单体聚合而成的是( )
| A. | ①⑤ | B. | ③④⑤ | C. | ②④⑤ | D. | ①②④ |
19.下列金属冶炼原理的化学反应中,属于置换反应的是( )
| A. | 电解熔融的氯化钠制取钠 | B. | 用一氧化碳还原氧化铁制取铁 | ||
| C. | 加热分解氧化汞制取汞 | D. | 铁与硫酸铜溶液反应制取铜 |
9.下列关于铝及其化合物的离子方程式不正确的是( )
| A. | AlCl3溶液中加入过量稀氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ | |
| B. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO${\;}_{2}^{-}$+2H2O═Al(OH)3↓+HCO${\;}_{3}^{-}$ | |
| C. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO${\;}_{2}^{-}$+3H2↑ | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO${\;}_{4}^{2-}$恰好完全沉淀:2Ba2++3OH-+Al3++2SO${\;}_{4}^{2-}$═2BaSO4↓+Al(OH)3↓ |
16.对物质的量浓度相同的溶液的描述正确的是( )
| A. | 溶液的质量相等 | |
| B. | 每升溶液中溶质的质量相等 | |
| C. | 相同体积的溶液,其溶质的物质的量相等 | |
| D. | 每升溶液中溶质的微粒数相等 |
13.用下列实验装置进行实验,能达到相应实验目的是( )
| A. | 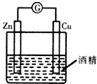 形成原电池 | B. | 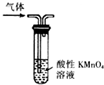 除去乙烯中混有的SO2 | ||
| C. | 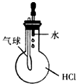 验证HCl气体在水中的溶解性 | D. | 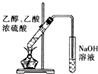 实验室制取乙酸乙酯 |
14.某些建筑材料中含有放射性元素氡(Rn).222Rn、219Rn、220Rn分别来自镭、锕、钍,因而分别称为镭射气、锕射气和钍射气.下列有关氡的说法正确的是( )
| A. | 氡是双原子分子 | |
| B. | 氡气因其化学性质活泼而对人体有害 | |
| C. | 氡气因其具有放射性而对人体有害 | |
| D. | 222Rn、219Rn、220Rn互为同素异形体 |