题目内容
 Ⅰ.依据氧化还原反应:2Ag+(aq)+Cu (s)=Cu2+(aq)+2Ag(s) 设计的原电池如图所示.请回答:
Ⅰ.依据氧化还原反应:2Ag+(aq)+Cu (s)=Cu2+(aq)+2Ag(s) 设计的原电池如图所示.请回答:(1)电极X的材料是
(2)银电极为电池的
(3)外电路中的电子从
Ⅱ.钢铁易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的1/4.因此钢铁设备通常需要被保护.如在船身上装锌块,锌块与钢铁形成
考点:原电池和电解池的工作原理
专题:电化学专题
分析:I.含有盐桥的原电池中,电极材料与相应的电解质溶液中金属阳离子属于相同元素,负极上失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极;
II.将化学能转化为电能的装置为原电池,易失电子的电极为负极,作原电池负极或电解池阳极的金属加速被腐蚀,作原电池正极或电解池阴极的金属被保护.
II.将化学能转化为电能的装置为原电池,易失电子的电极为负极,作原电池负极或电解池阳极的金属加速被腐蚀,作原电池正极或电解池阴极的金属被保护.
解答:
解:Ⅰ.(1)含有盐桥的原电池中,电极材料和相应的电解质溶液中金属阳离子属于相同元素,所以X的材料为Cu,Y为AgNO3溶液,故答案为:Cu;AgNO3溶液;
(2)锌电极易失电子作负极,银作正极,正极上银离子得电子发生还原反应,电极反应式为Ag++e-=Ag,铜电极上铜失电子发生氧化反应,电极反应式为Cu-2e-=Cu2+,
故答案为:正极;Ag++e-=Ag;Cu-2e-=Cu2+;
(3)原电池中,电子从负极沿导线流向正极,所以电子从铜沿导线流向银,故答案为:Cu;Ag;
Ⅱ.锌、铁和海水能将化学能转化为电能,为原电池,锌易失电子发生氧化反应而作负极,作电解池阴极的金属被保护,所以钢闸作阴极,故答案为:原电池;氧化;阴极.
(2)锌电极易失电子作负极,银作正极,正极上银离子得电子发生还原反应,电极反应式为Ag++e-=Ag,铜电极上铜失电子发生氧化反应,电极反应式为Cu-2e-=Cu2+,
故答案为:正极;Ag++e-=Ag;Cu-2e-=Cu2+;
(3)原电池中,电子从负极沿导线流向正极,所以电子从铜沿导线流向银,故答案为:Cu;Ag;
Ⅱ.锌、铁和海水能将化学能转化为电能,为原电池,锌易失电子发生氧化反应而作负极,作电解池阴极的金属被保护,所以钢闸作阴极,故答案为:原电池;氧化;阴极.
点评:本题考查了原电池和电解池原理,原电池设计是学习重点和难点,根据电池反应式中元素化合价变化确定正负极及电解质溶液,也是高考热点,难度中等.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
下列离子方程式正确的是( )
| A、澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O |
| B、稀硫酸与氢氧化钡溶液混合:H++SO42-+Ba2++OH-=H2O+BaSO4↓ |
| C、铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag |
| D、氧化铁与稀盐酸混合:Fe2O3+6H+=2Fe3++3H2O |
在自然界中既能以游离态存在又能以化合态存在的元素是( )
| A、钠 | B、硫 | C、氯 | D、钙 |
下列各装置中铜电极上能产生气泡的是( )
A、 |
B、 |
C、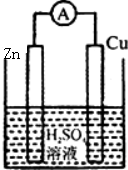 |
D、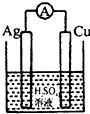 |
 硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下.
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下.