题目内容
6.恒温下,在2个体积相等的恒容密闭容器中反应2A(g)+B(g)?3C(g)达到平衡,若甲容 器起始投入2molA、1molB,乙容器起始投入1molC,下列说法正确的是( )| A. | 两容器内压强一定相等 | B. | 两容器中A的浓度一定相等 | ||
| C. | 两容器吸收或放出的热量一定相等 | D. | 两容器中B的百分含量一定相同 |
分析 对于反应2A(g)+B(g)?3C(g),反应物与生成物的气体的计量数之和相等,则改变压强,平衡不移动,甲容 器起始投入2molA、1molB,乙容器起始投入1molC,物质的配比数相等,为等效平衡,达到相同平衡状态,各物质的含量相等,以此解答该题.
解答 解:对于反应2A(g)+B(g)?3C(g),反应物与生成物的气体的计量数之和相等,则改变压强,平衡不移动,
2A(g)+B(g)?3C(g),
甲:2mol 1mol
乙相当于:$\frac{2}{3}$mol $\frac{1}{3}$mol
甲、乙中n(A):n(B)=2:1,为等效平衡,达到相同平衡状态,各物质的含量相等,但由于体积相等,物质的量不等,则压强、浓度以及反应放出、吸收的热量不等.
故选D.
点评 本题考查的是等效平衡及化学平衡的有关计算,为高频考点,侧重考查学生的分析、计算能力,注意反应中两边气体的化学计量数相等,压强不影响平衡的移动,本题难度中等.

练习册系列答案
相关题目
16.某不纯的烧碱样品,含Na2CO3 1.06%(质量百分含量)、H2O 3.6%、NaOH 95.34%,.取m g样品溶于2mol/L盐酸40mL得溶液A(假设生成的气体全部逸出),用20mL2mol/L NaOH溶液恰好中和剩余的酸,则A溶液中含溶质氯化钠的质量为( )
| A. | 4.68 g | B. | 6..68 g | ||
| C. | 2.34 g | D. | 由于m未知,无法计算 |
17.下列离子方程式正确的是( )
| A. | 铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 饱和石灰水跟盐酸反应:H++OH-═H2O | |
| C. | 在硫酸溶液中加入氢氧化钡溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 碳酸钙中加入盐酸:CO32-+2H+═CO2↑+H2O |
1.N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g)?4NO2(g)+O2(g)△H>0.T1温度时,向密闭容器中通入N2O5气体,部分实验数据见表:下列说法正确的是( )
| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/(mol•L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500s内O2的平均生成速率为7.4×l0-4mol•L-1•s-1 | |
| B. | T1温度下该反应达到平衡时,平衡混合物中NO2的体积分数为50% | |
| C. | 达到平衡后,其他条件不变,将容器体积压缩到原来的1/2,则c(N2O5)>5.00mol•L-1 | |
| D. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若K1<K2,则T1>T2 |
11.用已知浓度的酸滴定未知浓度的碱时,用甲基橙作指示剂,会导致待测碱液的浓度偏低的操作是( )
①酸式滴定管用蒸馏水洗后,未用标准液润洗
②碱式滴定管用蒸馏水洗后,未用待测液润洗
③锥形瓶用蒸馏水洗后,用待测夜润洗
④滴定前酸式滴定管尖嘴部分有气泡,滴定完成后气泡消失
⑤滴定中不慎将锥形瓶内液体摇出少量于瓶外.
①酸式滴定管用蒸馏水洗后,未用标准液润洗
②碱式滴定管用蒸馏水洗后,未用待测液润洗
③锥形瓶用蒸馏水洗后,用待测夜润洗
④滴定前酸式滴定管尖嘴部分有气泡,滴定完成后气泡消失
⑤滴定中不慎将锥形瓶内液体摇出少量于瓶外.
| A. | ①③④ | B. | ②⑤ | C. | ②③⑤ | D. | ②④ |
15.下列有关实验操作正确的是( )
| A. | 用手接触药品 | |
| B. | 用一只酒精灯点燃另一只酒精灯 | |
| C. | 实验后,剩余的药品不能放回原瓶,也不能随便丢弃 | |
| D. | 将带有溶液的胶头滴管平放在实验台上 |
16.某同学设计下列方法对A盐的水溶液进行鉴定:
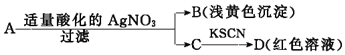
由此得出的结论中,不正确的是( )

由此得出的结论中,不正确的是( )
| A. | D溶液中存在Fe(SCN)3 | B. | 滤液C中有Fe3+ | ||
| C. | B为AgBr | D. | A一定是FeBr2 |