题目内容
13.wg铁粉和铝粉的混合物和过量的NaOH反应,然后过滤,将沉淀完全收集后,放蒸发皿中加热,直至被加热的物质质量不再变化.取出蒸发皿中的物质称量仍为wg.求原混合物中铝粉的质量分数是( )| A. | 27.6% | B. | 30% | C. | 47% | D. | 78% |
分析 wg铁粉和铝粉的混合物,和过量的NaOH反应,然后过滤,滤渣为Fe,放入蒸发皿中完全灼烧后最终应生成Fe2O3,取出蒸发皿中的物质称量仍为wg,则铝粉的质量等于Fe2O3中O元素的质量,以此计算原混合物中铝粉的质量分数.
解答 解:wg铁粉和铝粉的混合物,和过量的NaOH反应,然后过滤,滤渣为Fe,
放入蒸发皿中完全灼烧后最终应生成Fe2O3,
取出蒸发皿中的物质称量仍为wg,
则铝粉的质量等于Fe2O3中O元素的质量,
则有原混合物中铝粉的质量分数为:$\frac{3×16}{3×16+2×56}$×100%=30%,
故选B.
点评 本题考查混合物的计算,题目难度不大,本题注意分析金属混合物反应前后物质的成分的变化,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
3.关于中和热的测得实验,下列说法正确的是( )
| A. | 为了使反应进行的更完全,可以使酸或碱适当过量 | |
| B. | 为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸) | |
| C. | 因为中和热为一定值,所以实验结果与所用酸(碱)的用量 和种类均无关 | |
| D. | 测酸溶液的温度后,未冲洗温度计就直接测碱溶液的温度,会使中和热的数值偏大 |
4.短周期主族元素X,Y,Z,W的原子序数均为偶数且依次增大,Z的原子序数是X的2倍,W的质子数是X,Y的质子数之和,下列叙述正确的是( )
| A. | 元素X与Z同主族 | |
| B. | 原子半径:r(W)>r(X)>r(Y)>r(Z) | |
| C. | 由元素X,Y,Z形成的常见化合物为共价化合物 | |
| D. | 最简单气态氢化物的稳定性由强到弱的顺序:Y、X、W |
1.X、Y、Z、W 为四种短周期主族元素,且原子序数依次增大.已知X原子的最外层电子数是其电子层数的2倍,Y是地壳中含量最高的元素,Y原子的最层电子数是W原子最外层电子数的2倍,Z原子的最外层上只有一个电子.下列说法正确的是( )
| A. | 原子半径:r(Z)>r(W)>r(X)>r(Y) | |
| B. | Y与Z 两种元素只能形成一种化合物 | |
| C. | 最高价氧化物对应水化物的碱性:Z<W | |
| D. | X的简单气态氢化物的热稳定性比Y的强 |
8.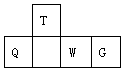 短周期元素T、Q、W、G在元素周期表中的相对位置如图所示,其中Q是无机非金属材料的主角.下列判断正确的是( )
短周期元素T、Q、W、G在元素周期表中的相对位置如图所示,其中Q是无机非金属材料的主角.下列判断正确的是( )
 短周期元素T、Q、W、G在元素周期表中的相对位置如图所示,其中Q是无机非金属材料的主角.下列判断正确的是( )
短周期元素T、Q、W、G在元素周期表中的相对位置如图所示,其中Q是无机非金属材料的主角.下列判断正确的是( )| A. | 原子半径:W<T | |
| B. | 最简单气态氢化物的热稳定性:Q<T | |
| C. | 最高价氧化物对应水化物的酸性:W<Q | |
| D. | 简单离子的还原性:W<G |
5.硫酸铁铵[Fe2(SO4)3•(NH4)2SO4•6H2O]广泛用于生活用水的净化处理.制备硫酸铁铵的实验中,过滤出产品后,常温下另取母液(pH<1),向其中加入指定物质,反应后溶液中主要存在的一组离子正确的是( )
| A. | 加入过量NaOH溶液:Na+、NH4+、SO42-、OH- | |
| B. | 加入过量KI溶液:K+、Fe2+、NH4+、SO42-、I- | |
| C. | 加入过量BaCl2溶液:Ba2+、NH4+、Fe3+、SO42-、Cl- | |
| D. | 加入过量KSCN溶液:K+、NH4+、Fe3+、SO42-、SCN- |
2.设NA为阿伏加德罗常数的值.下列有关叙述正确的是( )
| A. | 常温常压下,5.6L甲烷与乙烯的混合气体中含氮原子数为NA | |
| B. | 72gCaO2固体中含离子总数为3NA | |
| C. | 向1LO.lmol/LKMnO4酸性溶液中通入足量SO2,转移电子效为0.5NA | |
| D. | 0.lmol氯气完全溶于水得1L氯水,溶液中ClO-数目是0.1NA |
3.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 常温下,4.6gNO2含分子数为0.1NA | |
| B. | 250mL1mol•L-1FeCl3溶液中,阴、阳离子总数等于NA | |
| C. | 标准状况下,aLCH4和aLC6H14所含分子数均为aNA/22.4 | |
| D. | 1molO2与足量金属钠反应,O2得到的电子数不一定为4NA |
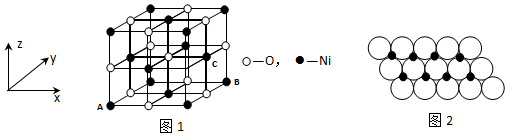
 ,Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为1:1.
,Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为1:1.