题目内容
3.设NA为阿伏加德罗常数,下列说法正确的是( )| A. | 常温下,4.6gNO2含分子数为0.1NA | |
| B. | 250mL1mol•L-1FeCl3溶液中,阴、阳离子总数等于NA | |
| C. | 标准状况下,aLCH4和aLC6H14所含分子数均为aNA/22.4 | |
| D. | 1molO2与足量金属钠反应,O2得到的电子数不一定为4NA |
分析 A.二氧化氮与四氧化二氮存在反应NO2?N2O4;
B.三价铁离子在水溶液中会水解;
C.标况下C6H14不是气体;
D.氧气和钠反应条件不同产物不同.
解答 解:A.常温下,4.6gNO2含分子数为$\frac{4.6g}{46g/mol}$×NA=0.1NA,二氧化氮与四氧化二氮存在反应NO2?N2O4,所以实际4.6gNO2含分子数小于0.1NA,故A错误;
B.1 mol铁离子会水解,生成3mol的氢离子,所以250mL1mol•L-1FeCl3溶液中,阴、阳离子总数大于阿伏加德罗常数,故B错误;
C.气体摩尔体积使用对象为气体,标况下C6H14不是气体,不能使用气体摩尔体积,故C错误;
D.氧气和钠反应可以生成氧化钠,也可以生成过氧化钠,2mol O2与金属钠反应,反应生成氧化钠电子转移4mol,生成过氧化钠电子转移2mol,O2不一定得到4NA个电子,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积条件应用,可逆反应分析,氧化还原反应的转移计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
13.wg铁粉和铝粉的混合物和过量的NaOH反应,然后过滤,将沉淀完全收集后,放蒸发皿中加热,直至被加热的物质质量不再变化.取出蒸发皿中的物质称量仍为wg.求原混合物中铝粉的质量分数是( )
| A. | 27.6% | B. | 30% | C. | 47% | D. | 78% |
14.下列关于有机物的说法正确的是( )
| A. | 苯不能使酸性高锰酸钾溶液褪色,所以苯不能发生氧化反应 | |
| B. | 1mol葡萄糖能水解生成2mol乙醇和2mol二氧化碳 | |
| C. | 戊烷的一氯代物和丙烷的二氯代物的同分异构体数目相同 | |
| D. | 异丙醇能发生取代反应、氧化反应、消去反应等 |
11.水芹烯、罗勒烯、月桂烯均为中药当归的成分,它们的结构简式如图所示:
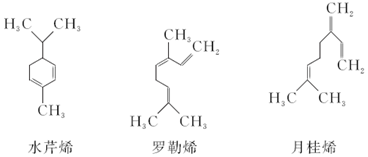
已知烯烃中不饱和碳原子与酸性KMnO4溶液反应的产物:
CH2=→HCOOH→CO2,RCH=→RCHO→RCOOH, →
→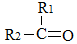
下列有关这三种有机物的判断正确的是( )

已知烯烃中不饱和碳原子与酸性KMnO4溶液反应的产物:
CH2=→HCOOH→CO2,RCH=→RCHO→RCOOH,
 →
→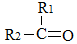
下列有关这三种有机物的判断正确的是( )
| A. | 三者互为同分异构体 | |
| B. | 三者与酸性KMnO4溶液反应的氧化产物中均有CO2 | |
| C. | 相同质量的三种物质与Br2发生加成反应消耗相同量的Br2 | |
| D. | 三者分子中所有碳原子均在同一个平面内 |
18.下列各组物质发生化学反应时,由于反应物的量不同而导致生成不同产物的是( )
①CO2与NaOH溶液
②盐酸溶液与偏铝酸钠溶液
③NaHCO3溶液与盐酸
④高温下焦炭与O2
⑤AlCl3溶液与氢氧化钠溶液
⑥铁与稀硝酸.
①CO2与NaOH溶液
②盐酸溶液与偏铝酸钠溶液
③NaHCO3溶液与盐酸
④高温下焦炭与O2
⑤AlCl3溶液与氢氧化钠溶液
⑥铁与稀硝酸.
| A. | 除②外 | B. | 除③外 | C. | 除②③⑤⑥外 | D. | 除③⑥外 |
8.某有机物分子式为C4H8,据此推测其结构和性质均正确的是( )
| A. | 它与乙烯一定是同系物 | |
| B. | 它一定能使溴水褪色 | |
| C. | 它的一氯代物可能只有一种 | |
| D. | 等质量CH4和C4H8分别在氧气中完全燃烧,CH4的耗氧量小于C4H8 |
15.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 向KI溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 碘易溶于CCl4,难溶于水 |
| B | 向某溶液中滴加BaCl2溶液,随后加稀硝酸酸化 | 溶液中产生白色沉淀,加稀硝酸不溶解 | 原溶液中一定含有SO42- |
| C | 将稀硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中 | 溶液变黄色 | 氧化性:H2O2比Fe3+强 |
| D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
12.原子序数依次增大的五种短周期主族元素X、Y、Z、P、Q分别位于三个周期,X与Z、Y与P分别位于同主族,Z与Y可形成原子个数比分别为1:1和2:1的离子化合物.则下列说法正确的是( )
| A. | 单质的沸点:Q>P | |
| B. | 简单氢化物的热稳定性:Y>P | |
| C. | 简单离子的半径:Z>Y>X | |
| D. | X、Y、Z、P形成的化合物的水溶液显碱性 |
20.向50mL14.0mol•L-1浓硝酸中加入足量的铜,充分反应后共收集到标准状况下2.24L NO和NO2混合气体(不考虑NO2与N2O4的相互转化),则参加反应的铜的质量为( )
| A. | 6.4g | B. | 12.8g | C. | 19.2g | D. | 38.4g |