题目内容
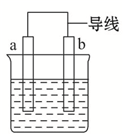 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:(1)当电极a为Fe、电极b为Cu、电解质溶液为稀硫酸时,该电池的总反应离子方程式为
(2)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,则该电池的正极材料是:
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)Fe、Cu、稀硫酸构成的原电池,金属Fe作负极,金属Cu为正极,正极上氢离子得到电子,负极上Fe失去电子;
(2)Al、Mg、NaOH溶液构成的原电池中,Al为负极,Mg为正极,负极上Al失去电子,正极上水中的氢离子得到电子,以此来解答.
(2)Al、Mg、NaOH溶液构成的原电池中,Al为负极,Mg为正极,负极上Al失去电子,正极上水中的氢离子得到电子,以此来解答.
解答:
解:(1)Fe、Cu、稀硫酸构成的原电池,金属Fe作负极,金属Cu为正极,正极上氢离子得到电子,负极上Fe失去电子,电池总反应为:2H++Fe=H2↑+Fe2+,当电路中有0.2mol e-通过时,反应的Fe的物质的量为0.1mol,则负极Fe的质量减少为0.1mol×56g/mol=5.6g;
故答案为:2H++Fe=H2↑+Fe2+;5.6;
(2)Al、Mg、NaOH溶液可构成原电池,Al为负极,Mg为正极,负极上Al失去电子,正极上水中的氢离子得到电子,发生电池反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
故答案为:镁;2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
故答案为:2H++Fe=H2↑+Fe2+;5.6;
(2)Al、Mg、NaOH溶液可构成原电池,Al为负极,Mg为正极,负极上Al失去电子,正极上水中的氢离子得到电子,发生电池反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
故答案为:镁;2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
点评:本题考查原电池原理,把握图中装置的分析及原电池的工作原理为解答的关键,侧重电极、电极反应、转移电子的考查,题目难度中等.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
下列各组混合物,可以用分液漏斗分离的是( )
| A、甲苯和水 | B、甲苯和苯 |
| C、溴乙烷与水 | D、苯与溴乙烷 |
用下列实验装置进行相应的实验,不能达到实验目的是( )


| A、图Ⅰ所示装置用于实验室制取氨气 |
| B、图Ⅱ所示装置用于制备少量氢气 |
| C、图Ⅲ所示装置用于测定中和反应的反应热. |
| D、图IV所示装置用于证明非金属性强弱S>C>Si |
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )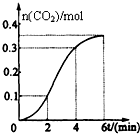

| A、反应开始2分钟内平均反应速率最大 |
| B、反应4分钟后平均反应速率最小 |
| C、反应开始4分钟内温度对反应速率的影响比浓度大 |
| D、反应4分钟后反应速率下降的原因是盐酸浓度逐渐减小 |
下列说法错误的是( )
| A、医学上用于消毒的酒精是75%酒精溶液 |
| B、单质硅是将太阳能转化为电能的常用材料 |
| C、食醋是含3%~5%乙酸的溶液 |
| D、乙醇可做为提取碘水中碘的萃取剂 |
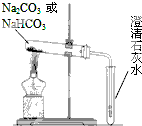 碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱.
碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱.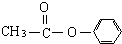 、
、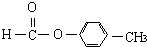 外还有四种,请分别写出结构简式:
外还有四种,请分别写出结构简式: