题目内容
19.实验表明,H2可以还原氮的氧化物,如:2H2(g)+2NO(g)?N2(g)+2H2O (g).在四个相同的恒容密闭容器中,分别控制四种不同的条件使之发生上述反应,H2的起始浓度为1.5mol•L-1,N2(g、H2O(g)的起始浓度均为0.实验测得NO的浓度随反应时间的变化如图所示(四种不同的柱状图代表四种不同条件下NO的浓度,其中实验2和实验3中NO的起始浓度在柱状图中均未画出,假设分别为c1和c2).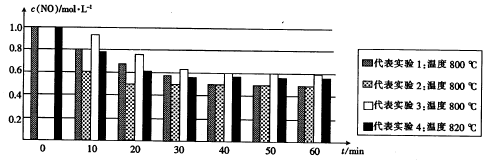
(1)比较实验1与实验2达到平衡时的柱状图可推测,在实验2中NO的起始浓度c1=(填“>”“<”或“=”)1mol•L-1,实验2中隐含的条件是催化剂.
(2)在40-60min内实验1中NO的平均反应速率为v1,实验3中NO的反应速率为v3,则v1 < v3,且c2=1.0mol•L-1.(填“>”、“<”或“=”)
(3)比较实验1和实验4,可推测该反应是放热(填“吸热”或“放热”)反应.
分析 (1)比较平衡时实验1和实验2中NO的浓度可判断出实验2中NO的初始浓度,达到平衡状态所需时间,结合影响化学反应速率的因素判断;
(2)实验1、3比较,温度相同,40~60min时,实验3、实验1都处于平衡状态,由于实验1、3是在相同温度下进行的反应,而平衡时实验3中NO的浓度高,所以实验3的起始浓度大于实验1的;
(3)图象中实验1和4的起始量相同,不同温度下达到平衡状态,实验4中NO浓度大于实验1,温度升高平衡向吸热反应方向进行;
解答 解:(1)根据实验1、2数据分析,温度相同,达平衡后NO的物质的量浓度相同,且N2(g、H2O(g)的起始浓度均为0,所以两组实验中NO的起始浓度相同为1.0mol•L-1 ;温度相同,达平衡后NO的物质的量浓度相同,但达平衡时2组的时间较短,所以只能是加入催化剂,
故答案为:=;催化剂;
(3)实验1、3比较,温度相同,40~60min时,实验3、实验1都处于平衡状态,由于实验1、3是在相同温度下进行的反应,而平衡时实验3中NO的浓度高,所以实验3的起始浓度大于实验1的,c3>1.0mol•L-1,反应速率大,v1<v3,实验1、2达到相同平衡状态,c2=1.0mol•L-1,
故答案为<;=;
(3)比较实验1和实验4,图象中实验1和4的起始量相同,不同温度下达到平衡状态,实验4中NO浓度大于实验1,说明温度升高平衡向吸热反应方向进行,2H2(g)+2NO(g)?N2(g)+2H2O (g),升温平衡逆向进行,逆反应为吸热反应,正反应为放热反应,
故答案为:放热.
点评 本题考查了化学平衡化学反应速率的计算、平衡常数的计算及应用、影响反应速率及平衡移动的因素等知识点,题目难度中等,解题时注意基础知识的灵活运用.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案
相关题目
5.已知Fe3O4可表示成FeO•Fe2O3,水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O,下列说法正确的是( )
| A. | O2和S2O32-是氧化剂,Fe2+是还原剂 | |
| B. | 每生成1 mol Fe3O4,则转移电子2 mol | |
| C. | 氧化产物只有Fe3O4,还原产物只有S4O62- | |
| D. | 若有4 mol Fe2+被氧化,则被Fe2+还原的O2为1 mol |
10.以下命题,违背化学变化规律的是( )
| A. | 石墨制成金刚石 | B. | 煤加氢变成人造石油 | ||
| C. | 水变成汽油 | D. | 干冰转化成原子晶体 |
7.能正确表示下列反应的离子方程式是( )
| A. | 向含有FeBr2的溶液中通入过量Cl2充分反应:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 | |
| B. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| C. | 磁性氧化铁溶于稀硝酸:3 Fe2++4H ++NO3-═3Fe3++NO↑+3H2O | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2 SO42-═2BaSO4↓+Al(OH)3↓ |
4.下列叙述中不正确的是( )
| A. | 氢氧化钙的摩尔质量是74 g•mol-1 | B. | 阿伏加德罗常数是6.02×1023 | ||
| C. | 1 mol H | D. | 1 mol CO约含有6.02×1023个CO |
11.下列化学反应的离子方程式正确的是( )
| A. | 碳酸氢钙溶液与盐酸反应:Ca(HCO3)2+2H+═Ca 2++2H2O+2CO2↑ | |
| B. | 往氨水中滴加氯化铁:Fe 3++3HO-═Fe(OH)3↓+2H2O | |
| C. | 氯化钡溶液与硫酸反应:Ba2++SO42-═BaSO4↓ | |
| D. | Mg(HCO3)2溶液中加入足NaOH溶液:Mg2++HCO3-+3OH═Mg(OH)2↓+CO32-+H2O |

 ,其苯环上的二溴代物有9种,苯环上的四溴代物有9种.
,其苯环上的二溴代物有9种,苯环上的四溴代物有9种.