题目内容
10.以下命题,违背化学变化规律的是( )| A. | 石墨制成金刚石 | B. | 煤加氢变成人造石油 | ||
| C. | 水变成汽油 | D. | 干冰转化成原子晶体 |
分析 A.石墨与金刚石属于碳的同素异形体,在一定条件下可以转化;
B.人造石油是从煤或油页岩等中提炼出的液态碳氢化合物;
C.水中无碳元素,而石油中含有碳元素,根据质量守恒定律,故水不会变成汽油;
D.干冰为固态二氧化碳,在一定条件下可以转化成原子晶体.
解答 解:A.石墨与金刚石为碳元素的不同单质,在一定条件下可以转化,符合化学变化规律,故A不选;
B.煤主要含有碳氢化合物,将碳加氢可以合成人造石油,属于化学变化,符合化学变化规律,故B不选;
C.水中无碳元素,而石油中含有碳元素,根据质量守恒定律,故水不会变成汽油,所以违背化学变化规律,故C选;
D.固态二氧化碳俗称干冰,在一定条件下可以将干冰转化成原子晶体,符合科学规律,故D不选;
故选C.
点评 本题考查化学反应的本质,题目难度不大,掌握质量守恒定律的内容及其应用即可解答,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.

练习册系列答案
 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
17.下列关于有机化合物的说法错误的是( )
| A. | 己烷有4种同分异构体,它们的熔沸点不相同 | |
| B. | 在一定条件下,苯与液溴、硝酸作用生成溴苯、硝基苯的反应都属于取代反应 | |
| C. | 烷烃的通式为CnH2n+2,随n值增大,碳元素的质量百分含量逐渐增大 | |
| D. | 聚合物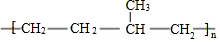 由单体CH3CH=CH2和CH2=CH2加聚制得 由单体CH3CH=CH2和CH2=CH2加聚制得 |
14.正确认识铁制品的电化学腐蚀与防护方法的是( )
| A. | 铁制品腐蚀时既可作正极也可作负极 | |
| B. | 铁制品腐蚀时铁电极发生反应为:Fe-3e-=Fe2+ | |
| C. | 铁制品腐蚀时或发生析氢腐蚀或发生吸氧腐蚀 | |
| D. | 铁制品连接电源正极可防止腐蚀 |
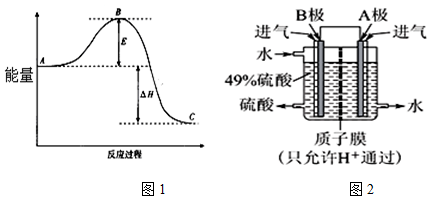
15. 50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.
50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
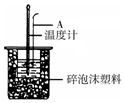
(2)如图所示,仪器A的名称是环形玻璃搅拌棒;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H>-57.3KJ/mol(填“>”、“<”或“=”);
(3)根据上表中所测数据进行计算(近似认为盐酸和NaOH溶液的密度都是1g•cm-3,中和后生成溶液的比热容c=4.18J•g-1•℃-1),则中和热△H=-56.8kJ/mol (取小数点后一位).
(4)若某同学利用如图装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是ABDF.
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大.
 50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.
50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
(2)如图所示,仪器A的名称是环形玻璃搅拌棒;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H>-57.3KJ/mol(填“>”、“<”或“=”);
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
(4)若某同学利用如图装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是ABDF.
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大.
2.向明矾溶液中逐渐滴加Ba(OH)2溶液,符合要求的离子方程式为( )
| A. | 加入过量的Ba(OH)2溶液时:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| B. | 溶液恰好呈中性时:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | SO42-离子恰好完全沉淀时:Al3++SO42-+Ba2++4OH-═AlO2-+BaSO4↓+2H2O | |
| D. | 明矾与Ba(OH)2按物质的量比1:1反应时:Al3++SO42-+Ba2++3OH-═Al(OH)3↓+BaSO4↓ |