题目内容
4.在相同温度下,下列两个反应放出的热量分别用Q1和Q2表示:H2(g)+$\frac{1}{2}$O2(g)=H2O(g) Q1
2H2(g)+O2(g)=2H2O(l) Q2
下列有关Q1和Q2的关系说法正确的是( )
| A. | Q1=Q2 | B. | Q1=$\frac{1}{2}$Q2 | C. | Q1<$\frac{1}{2}$Q2 | D. | Q1>$\frac{1}{2}$Q2 |
分析 氢气燃烧为放热反应,热量Q为正值,物质的量与Q成正比,且H2O(g)能量大于H2O(l)的能量,以此来解答.
解答 解:由2H2(g)+O2(g)=2H2O(l) Q2,可知H2(g)+$\frac{1}{2}$O2(g)=H2O(l)Q=$\frac{1}{2}$Q2,
H2O(g)能量大于H2O(l)的能量,
H2(g)+$\frac{1}{2}$O2(g)=H2O(g) Q1,
则Q>Q1,即$\frac{1}{2}$Q2>Q1,
故选C.
点评 本题考查反应热与焓变,为高频考点,把握物质的量与能量的关系为解答的关键,侧重分析与应用能力的考查,注意气态水的能量大于液态水的能量,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g)+4H2(g)?CH4(g)+2H2O(g)
已知H2的体积分数随温度的升高而增加.若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化.(选填“增大”、“减小”或“不变”)
相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如表:
a、b、c、d与m、n、x、y之间的关系式为.
已知H2的体积分数随温度的升高而增加.若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化.(选填“增大”、“减小”或“不变”)
| v正 | v逆 | 平衡常数K | 转化率α |
| 增大 | 增大 | 减小 | 减小 |
| [CO2]/mol•L-1 | [H2]/mol•L-1 | [CH4]/mol•L-1 | [H2O]/mol•L-1 | |
| 平衡Ⅰ | a | b | c | d |
| 平衡Ⅱ | m | n | x | y |
12.下列反应中,熵显著增加的反应是( )
①CO(g)+2H2(g)═CH3OH(g)
②CaCO3(s)+2HCl(aq)═CaCl2(aq)+CO2(g)+H2O(l)
③C(s)+O2(g)═CO2(g)
④2HgO(s)═2Hg(l)+O2(g)
①CO(g)+2H2(g)═CH3OH(g)
②CaCO3(s)+2HCl(aq)═CaCl2(aq)+CO2(g)+H2O(l)
③C(s)+O2(g)═CO2(g)
④2HgO(s)═2Hg(l)+O2(g)
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
9.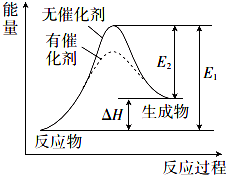 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列说法错误的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列说法错误的是( )
 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列说法错误的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列说法错误的是( )| A. | 该反应为吸热反应 | |
| B. | 催化剂不能改变反应的焓变(△H) | |
| C. | 催化剂能降低反应的活化能 | |
| D. | 逆反应的活化能大于正反应的活化能 |
16. 对于mA(s)+nB(g)?pC(g)△H<0的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )
对于mA(s)+nB(g)?pC(g)△H<0的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )
 对于mA(s)+nB(g)?pC(g)△H<0的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )
对于mA(s)+nB(g)?pC(g)△H<0的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )| A. | m+n<p | B. | n>p | ||
| C. | x点的状态是v正>v逆 | D. | 以上答案都错误 |
13.下列有关化学用语表示正确的是( )
| A. | 对烃基苯甲醛的结构简式: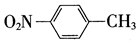 | B. | 质量数为37的氯原子:$\stackrel{37}{17}$Cl | ||
| C. | NH4Br的电子式: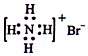 | D. | 二氧化碳分子的比例模型: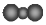 |
14.碳酸钠(Na2CO3)俗名纯碱,属于( )
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
